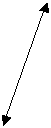Сравнительная
морфология респираторного повреждения при вирус- и сепсис- индуцированном
синдроме острого легочного повреждения
Новиков Н.Ю.
Острое развитие и стремительное прогрессирование патофизиологических событий у пациентов во время гриппа приводит к смерти в первые несколько суток от начала симптомов заболевания [1,2,3]. Было установлено, что в развитии летального исхода при гриппе решающее значение имеет синдром острого легочного повреждения (СОЛП) [4,5,6], возникающий также в результате повреждения аэрогематического барьера при сепсисе и других состояниях. Установлена разница в клинической картине между респираторным повреждением, вызванным прямым и непрямым повреждением респираторной паренхимы [7]. Морфологические различия между СОЛП при острых респираторных заболеваниях и СОЛП при сепсисе остаются изученными недостаточно.
Цель работы состояла в установлении патоморфологических особенностей летальной респираторной патологии, вызванной повреждающим действием прямых и непрямых факторов.
Материал и методы.
Изучали гистологические препараты 20 пациентов умерших в результате гриппа А H1N1 (подтвержденного полимеразной цепной реакцией) и 12 больных, умерших в результате сепсиса в сроки от 2 до 19 суток от начала заболевания. Дату начала заболевания определяли исходя из критериев СОЛП по шкале Мюррея. Гистологические препараты готовили по стандартной методике с заливкой материала в парафин. Окрашивали гематоксилином и эозином и по ван-Гизон. Для электронной микроскопии кусочки ткани легкого после стандартной проводки заливали в смесь эпоксидных смол, изготавливали ультратонкие срезы и просматривали в электронных микроскопах ПЭМ-100 (Украина, г. Сумы) и Jeol-1010 (Япония).
Результаты исследования.
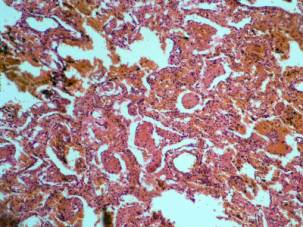
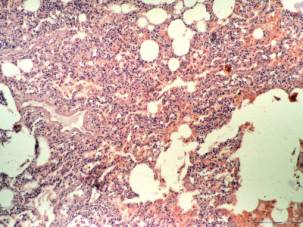
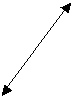
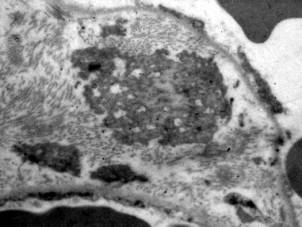
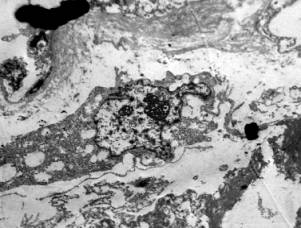
Патоморфологические изменения при гриппе и сепсисе в первые пять суток развития СОЛП характеризуются диффузным альвеолярным повреждением с усилением микропиноцитозного транспорта эндотелия, отеком интерстиция и резким субэпителиальным отеком. При сепсисе помимо указанных проявлений наблюдаются начальные явления фиброза аэрогематического барьера, что объясняется предшествующей, достаточно длительной для создания условий синтеза протеинов внеклеточного матрикса, системной воспалительной реакцией. Пролиферация и гиперплазия клеток альвеолярного эпителия гораздо раньше, чаще и с большей интенсивностью выявляется в случаях вирус-индуцированного заболевания. Этот факт объясняется тем, что при сепсисе, в отличие от вирусного, повреждение альвеолярного эпителия возникает вторично как следствие изменений интерстиция и базальной мембраны, а поэтому проявляется позже от начала регистрации клинических критериев СОЛП. Интерстициальный отек, и последующий интерстициальный фиброз по данным электронной микроскопии, более выражены при сепсисе, чем при гриппе, а признаки начинающейся карнификации имеют обратную взаимозависимость (Рис. 1, 2, 3, 4.).
|
|
|
|
Рис. 1. Микрофотография. Грипп 15 суток. Отек, внутриальвеолярные геморрагии, инфильтрация и коллагенизация межальвеолярных перегородок, начало карнификации. Окраска гематоксилином и эозином. Ув. 100. |
Рис. 2. Микрофотография. Сепсис 14 суток. Отек, уплотнение и консолидация легочной ткани, геморрагии, инфильтрация. Окраска гематоксилином и эозином. Ув. 100. |
|
|
|
|
Рис. 3. Электронная микрофотография. Грипп 15 суток. Расширение интерстиция за счет отека и отложения протеинов внеклеточного матрикса (стрелки). Организация волокон коллагена в пучки, между которыми видны широкие прослойки плотного межфибриллярного вещества (обведено пунктиром). Ув. 20000. |
Рис. 4. Электронная микрофотография. Сепсис 14 суток. Зрелый фибробласт с морфологическими признаками деструкции находится в расширенном за счет отека и коллагенизации интерстициальном пространстве (стрелка). Ув. 6000. |
Выводы
1. Синдром острого легочного повреждения в первые пять суток развития характеризуется патоморфологическими признаками диффузного альвеолярного повреждения с усилением микропиноцитозного транспорта эндотелия, отеком интерстиция и резким субэпителиальным отеком.
2. Развитие интерстициального фиброза при сепсис-индуцированном респираторном повреждении обусловлено продолжительностью предшествующего системного воспалительного ответа.
3. Вирус-индуцированное по сравнению с сепсис-индуцированным повреждением приводит к более ранней пролиферации альвеолярного эпителия и преобладанием карнификации над интерстициальным фиброзом.
Литература
1.
Левит А.Л. Особенности полиорганной недостаточности у
больных с внебольничной пневмонией, вызванной высокопатогенным вирусом гриппа A
(Н1N1) / А.Л.Левит, О.Г.Малкова, Ю.Э.Игумнова и др.// Инфекции в
хирургии. -2010. -№ 4.
-C. 13-16.
2.
Fumaggalli
L. Influenza A (H1N1) virus infection in ICU. / L. Fumaggalli, A. Lazzarin
// Minerva anesthesiologica. -2009. -№
75 (11)-P. 599–601.
3.
Domхnguez-Cherit
G. Critically ill patients with 2009 influenza A(H1N1) in Mexico
/Domхnguez-Cherit G, S.E. Lapinsky, A.E. Macias et al. // JAMA. -2009. -№ 302
(17). -P. 1880–1887.
4.
Teijaro
J. R. Endothelial Cells Are Central
Orchestrators of Cytokine Amplification during Influenza Virus Infection / J.
R. Teijaro, K. B. Walsh, S. Cahalan // Cell.
-2011. -Vol. 146, Issue 6. -P. 861-862.
5.
Capelozzi
V. L . Pathological and ultrastructural analysis of surgical lung biopsies in
patients with swine-origin influenza type A/H1N1 and acute respiratory failure
/ Vera Luiza Capelozzi, Edwin Roger Parra, Manoel Ximenes et al.// CLINICS. -
2010.-№65(12). -P. 1229-1237.
6. Грицык О.Б. Повреждение альвеолоцитов 2 типа при экспериментальном гриппе птиц А (H5N1) у различных видов животных /О.Б. Грицык, Э.Р. Абдуллазянова, Е.М. Малкова // Морфологические ведомости. -2011.-№ 2. -С. 30-35.
7. Власенко А. В. Патогенез, диагностика и дифференцированное лечение прямого и непрямого острого респираторного дистресс-cиндрома / А. В. Власенко, А. М. Голубев В. В. Мороз // III Научно-практическая конференция «Актуальные вопросы респираторной медицины». -Москва. – 2011. –С. 17-18.