К.х.н. С.Н.
Морозкина, Ш.Н. Абусалимов, д.б.н. Н.Д. Ещенко,
д.х.н. А.Г.
Шавва
Санкт-Петербургский
государственный университет, Россия
СИНТЕЗ И ИССЛЕДОВАНИЕ БИОЛОГИЧЕСКИХ СВОЙСТВ
1-МЕТИЛ-8α-АНАЛОГОВ СТЕРОИДНЫХ ЭСТРОГЕНОВ
Модифицированные стероидные эстрогены обладают широким спектром
биологических свойств, что позволило применять их в качестве средств
заместительной гормональной терапии [1]. Однако длительное применение
эстрогенов приводит к увеличению риска возникновения рака молочной железы [2],
рака эндометрия [3], тромбозов [4], инсультов [5] и других тяжелых болезней.
Поэтому поиск новых модифицированных аналогов эстрогенов с пониженной
канцерогенностью, сохранивших ряд полезных свойств, становится весьма
актуальным.
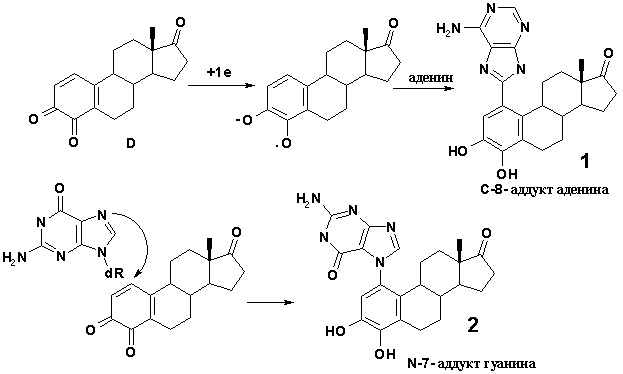
Схема 1.
В настоящее время считают, что существуют два основных типа
канцеро-генеза - промоторный и генотоксический (мутагенный), действие которых
может суммироваться [6]. Было выяснено, что окисление эстрогенов в организме
приводит к образованию сначала 2- или 4-гидроксиэстрогенов, которые затем
превращаются в хиноны. 2,3-Хиноны не опасны, поскольку обладают высокой
реакционной способностью и дезактивируются до миграции в ядра клеток,
3,4-хиноны образуют аддукты типа 1 и 2 [7,8] (схема 1).
Очевидно, что аналоги эстрогенов, содержащие заместитель при С-1, должны
обладать пониженной канцерогенностью. В то же время такие заместители могут
заметно изменить биологические свойства модифицированных веществ.
Учитывая сказанное выше, мы разработали
методы синтеза 1-метил-8α-аналогов стероидных эстрогенов (3-6), исследовали их утеротропную
активность и влияние на содержание липидов овариэктомированных крыс. Схема
синтеза новых соединений представлена ниже (схема 2).
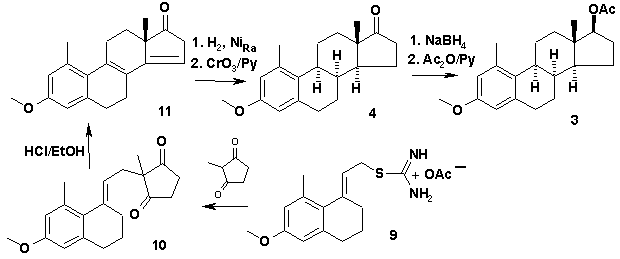
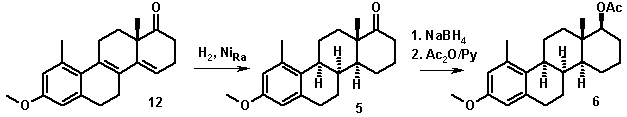 Схема 2.
Схема 2.
Ключевым соединением в данной схеме
является изотиуронивая соль 9, конденсация
которой с циклическими 1,3-дикетонами и циклодегидратация образующихся
секостероидов проходит без осложнений. Каталитическое гидрирование
эстрапентаенов на никеле Ренея в бензоле позволяет получить соединения
8α-ряда (4 и 5), строение которых доказано методами
спектроскопии ЯМР. Проведено полное отнесение сигналов в спектрах ЯМР 1Н
и 13С целевых стероидов. Показано, что стероид 3 находится в растворе в виде конформеров А и Б (Рис. 1).
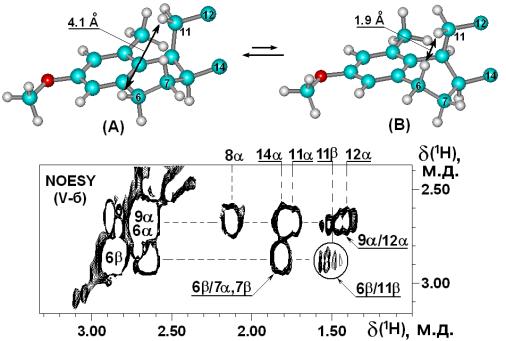
Рис.
1. Фрагмент спектра NOESY стероида 3.
Таблица 1. Влияние стероидов 3 и 5 на липиды
сыворотки крови овариэктомированных крыс
|
Группа крыс |
Изменение веса тела за время опыта, г |
Утеротропная активность |
Содержание холестерина в сыворотке крови, мг/дл |
Содержание триглицеридов в сыворотке крови, мг/дл |
|
|
100 г веса тела/100 г веса тела |
Содержание рецепторов прогес-терона, фмоль /100 мг белка |
||||
|
Интактные (10) |
40 ± 14 |
205 ±14** |
57.0 ± 4.8* |
58.5 ± 1.4* |
83.0 ± 5.2* |
|
ОВЭ (10) |
54 ± 18 |
38 ± 2 |
18.8 ± 1.8 |
76.5 ± 2.9 |
67.5 ± 5.4 |
|
ОВЭ, полу- чавшие ЕЕ |
16 ± 14 |
152 ± 10* |
98.8 ± 9.4* |
53.1 ± 3.0* |
133.4 ±15.6* |
|
ОВЭ, полу- чавшие (3) |
54 ± 8 |
58 ± 4* |
47.3 ± 3.0* |
47.3 ± 3.0* |
54.9 ± 3.3* |
|
ОВЭ, полу- чавшие (5) |
55 ± 12 |
63 ± 7* |
63.4 ± 15.4* |
58.5 ±2.2* |
66.0 ± 7.2 |
Таблица 2. Влияние стероидов 3 и 5 на липиды
сыворотки крови овариэктомированных крыс.
|
Группа крыс |
Изменение веса тела за время опыта, г |
Вес матки, мг |
Вес золы, г |
Содержание холестерина в сыворотке крови, мг/дл |
Содержание триглицеридов в сыворотке крови, мг/дл |
|
100 г веса тела |
«Влажный» вес кости, г |
||||
|
Ложноопе- рированные |
32.0 ± 3.5* |
163.8 ±16.9** |
0.4257 ±0.0068* |
47.7 ± 2.5* |
82.7 ± 5.4* |
|
ОВЭ |
48.2± 2.2 |
35.2± 1.9 |
0.3944±0.0087 |
68.8 ± 2.6 |
67.9 ± 5.5 |
|
ОВЭ, полу- чавшие ЕЕ |
11.0 ± 2.9* |
197.3±8.8** |
0.4326 ±0.0037* |
27.9 ± 2.6* |
125.5 ±17.4* |
|
ОВЭ, полу- чавшие (3) |
32.9 ± 3.1 |
52.9±1.8* |
0.4116 ±0.0064 |
52.5 ± 2.7 |
55.7 ± 3.6 |
|
ОВЭ, полу- чавшие (5) |
33.6± 2.9 |
62.8 ±2.3* |
0.4007±0.0055 |
49.2 ±2.6* |
60.4 ± 5.0 |
ОВЭ – овариэктомированные.
Препараты
вводили перорально в оливковом масле, ЕЕ (этинилэстрадиол) в дозе 0.1 мг/кг
веса тела в день, стероиды 2 и 3- в дозе 5 мг/кг веса тела в день. Опыты
продолжались 45 дней. Знак * означает достоверное различие по сравнению с
группой овариэктомированных животных, р<0.05, знак ** р<0.01 (t-критерий
Стьюдента). В каждой группе - по 10 животных.
1. Chen Yu,
Zeleniuch-Jacquotte A., Arslan A.A. et al. Atherosclerosis.
2011, 216(2), 214-419.
2. Beral V. &
Million Women Study Collaborators. Lancet.
2003, 362(9382), 419.
3. Beral V.,
Bull D., Reeves G. & Million Women Study
Collaborators. Lancet. 2005, 365(9469), 1543–1551.
4. Miller V.M., Jajachandran M., Heit J.A.,
Owen W.G. Pharmacology and Therapeutic.
2006, 113, 792.
5. Bushnell C.D. Lancet Neurology. 2005, 4(11), 743-752.
6. Берштейн Л.М. Онкоэндокринология. С-Петербург, Наука. 2004. 343
с.
7. Bolton J., Thatcher
G.R.J. Chem. Res. Toxicol., 2008, 21(1), 93-101.
8. Zhang Q., Aft R.L., Gross M.L.. Chem. Res. Toxicol., 2008,
21(8), 1509-1513.
9. Морозкина С.Н., Абусалимов
Ш.Н., Старова Г.Л., Селиванов С.И., Шавва А.Г. ЖОХ, 2010, 80, 1158.