Химия и химические технологии
Органическая химия
докторант PhD Шибаева А.К*.,
д.х.н., профессор Бакибаев А.А**.,
д.х.н.,
профессор Салькеева Л.К*., докторант PhD Тайшибекова Е.К*., Сагатов Е*.
*Карагандинский
государственный университет имени академика
Е.А. Букетова (г. Караганда, Казахстан)
**Национальный
исследовательский Томский политехнический университет, (г. Томск,
Россия)
Реакция
тетраметилолгликолурила с 2–амино–4–фенилтиазолом – удобный путь к новым азотсодержащим
гетероциклам
В последние годы наблюдается устойчивая
тенденция увеличения исследований, отражающих синтез и изучение свойств
гетероциклов с использованием в качестве синтона такого доступного соединения
как 2, 4, 6, 8 – тетраметилол – 2, 4, 6, 8 – тетраазабицикло [3.3.0.] октан – 3,7
– дион (тетраметилолгликолурил (ТМГУ)) [1-4].
С целью расширения препаративных возможностей
химической трансформации ТМГУ (I) под действием
азотистых оснований, нами изучены реакции конденсации ТМГУ (I) с
2–амино–4–фенилтиазолом (II) как представителем полифункционального
органического соединения.
ТМГУ (I) получали и выделяли по
методу [5],
а 2–амино–4–фенилтиазол (II) по методу [6].
В ходе наших исследований мы установили, что
направление взаимодействия ТМГУ (I) с
2–амино–4–фенилтиазолом (II) зависит, прежде всего,
от мольных количеств реагента (II).
Так, при использовании 2–х кратного избытка 2–амино–4–фенилтиазола
(II) за 4 часа преимущественно образуется продукт
азагетероциклизации (III) с выходом 64%, тогда
как при 4–х кратном избытке 2–амино–4–фенилтиазола (II) в анологичных условиях
нами выделен продукт конденсации (IV) с выходом 58%.

Невысокие выходы азагетероциклов (III)
и (IV), главным образом, связаны с тем обстоятельством, что в
изученных условиях протекают побочные реакции продуктов автоконденсации ТМГУ (I) с
2–амино–4–фенилтиазолом (II) с образованием сложной
смеси разномолекулярных соединений неустановленного строения (наличие в этих
соединениях аминотиазольного фрагмента надежно доказано с привлечением данных
ЯМР 1Н-спектров).
Кроме того, нами показано, что продукт
конденсации ТМГУ (I) с 2–амино–4–фенилтиазолом (II)
(соединение IV) за 4 часа с хорошим выходом (84%) азациклизуется в
соединение (III) реакция (3). Последнее обстоятельство свидетельствует о
том, что синтез соединения (III) в реакции (1) может пролегать
и через промежуточное образование тетратиазольного производного (IV).
Попытка осуществления одностадийного синтеза
азагетероцикла (III) по реакции Манниха (реакция 4) не
увенчалась особым препаративным успехом, т.к. в этом случае целевой продукт (III)
был выделен с низким выходом (17%), тогда как, в основном, в данном процессе
получались высокомолекулярные соединения неустановленного строения.
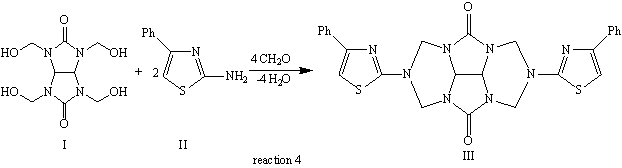
Синтезированные соединения (III)
и (IV) были изучены нами на их сорбционную активность по
отношению к ряду металлов (Zn, Cd, Pb, Cu).
Состав и структура полученных азагетероциклов (III)
и (IV) доказаны с привлечением данных элементного анализа, ЯМР 1Н-спектров
и масс-спектрометрии.
Таким образом, в данной работе нами показано, что
взаимодействие ТМГУ (I) с
2-амино-4-фенилтиазолом (II) приводит к новым
азотсодержащим гетероциклам, (III) и (IV),
которые привлекательны, с одной стороны – в качестве удобных синтонов для
дальнейшего препаративного превращения, а с другой стороны – являются
потенциальными носителями практически ценных свойств.
Литература:
1. D. Lucas., T. Minami., G. Iannuzzi., L. Cao., J. B. Wittenberg., P.
Anzenbacher., L. Isaacs. Journal of the American Chemical Society. – 2011.
– 133.
– 17966–17976.
2. L. Isaacs. Chem. Commun., 2009.
– 619–629.
3. А.Н. Кравченко., Г.А. Газиева., Н.Г. Колотыркина., Н.Н. Махова. Изв.
АН. Сер. Хим. – 2007. – 2195 [Russ. Chem. Bull., Int. Ed., 2007. – 56. – 2272].
4. N-F. She., X-G. Meng., M. Gao., A-X. Wu., L. Isaacs.
Chem. Commun. – 2008. – 3133–3135.
5. Petersen H. // Synthesis. – 1973. – Vol 5. – P. 257.
6. Мнджоян А.Л. // Синтезы гетероциклических
соединений – 1964. – Вып. 6. – С.20.