Химия и
химические технологии/ 5.Фундаментальные проблемы
создания
новых материалов и технологий.
Горбунова М.Н.1, Лемкина Л.М.2, Кисельков
Д.М.1, Чеканова Л.Г.1
1Институт технической химии УрО РАН, Пермь, Россия
2Институт экологии и генетики микроорганизмов УрО РАН,
Пермь, Россия
НОВЫЕ ГУАНИДИНСОДЕРЖАЩИЕ
СОПОЛИМЕРЫ
И НАНОКОМПОЗИТЫ НА ИХ
ОСНОВЕ
Нанокомпозиты, содержащие частицы металлов
в полимерной матрице, представляют интерес для медицины, электроники,
нанофотоники и катализа [1-3]. Наночастицы серебра обладают антимикробной
активностью, что позволяет использовать их для получения антибактериальных препаратов [2]. Одной из
проблем при получении нанокомпозитов является стабильность частиц серебра в наноразмерном состоянии. Из
литературы известно, что на стабильность частиц значительное влияние оказывает
природа наностабилизирующей матрицы [4].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2,2-Диаллил-1,1,3,3-тетраэтилгуанидиний
хлорид (АГХ) получали по методике [5]. Винилацетат фирмы “Lancaster” перегоняли в вакууме, использовали
фракцию с т.кип. 72ºС, n![]() = 1.3951. Сополимеризацию
АГХ с ВА проводили в массе в присутствии ДАК [6]. Сополимеры очищали двукратным
переосаждением из раствора в метаноле в диэтиловый
эфир и сушили в вакууме при 40-50ºС до постоянной массы. Состав сополимеров рассчитывали по
результатам элементного анализа.
= 1.3951. Сополимеризацию
АГХ с ВА проводили в массе в присутствии ДАК [6]. Сополимеры очищали двукратным
переосаждением из раствора в метаноле в диэтиловый
эфир и сушили в вакууме при 40-50ºС до постоянной массы. Состав сополимеров рассчитывали по
результатам элементного анализа.
Синтез
нанокомпозитов серебра и сополимера АГХ с ВА получали боргидридным методом.
Спектры
ЯМР 13С регистрировали на спектрометре “Bruker AM-300”. Спектры
поглощения регистрировали на спектрофотометре СФ 2000. Содержание Ag в водных растворах определяли на атомно-абсорбционном спектрометре iCE
3500 («Thermo Fisher Scientific», США).
Определение противомикробной активности
проводили методом двукратных серийных разведений [7] на музейных тест-культурах
Staphylococcus aureus ATCC 25923, Micrococcus luteus NCIMB 196 и Escherichia coli ATCC 25922. Все препараты в концентрации 1000 мкг/мл H2O раститрованы в 96-луночных иммунологических
планшетах в среде LB. После
внесения индикаторных культур в объеме 10 µl/ лунку,
содержащих 106 КоЕ/мл, планшеты инкубировали при 30° или 37°
в течение 18 часов, затем окрашивали смесью тетразолия и феназинметосульфата.
Контролем служили среда LB с
соответствующей индикаторной культурой. Учет результатов проводили по наличию и
характеру роста культур на питательной
среде.
РЕЗУЛЬТАТЫ И
ИХ ОБСУЖДЕНИЕ
Синтез нанокомпозитов
серебра с сополимером АГХ проводили восстановлением нитрата серебра боргидридом
натрия в водном растворе сополимера. Реакция протекает с образованием
устойчивых коричневых золей, из которых были выделены нанокомпозиты,
растворимые в спирте и воде. В зависимости от способа выделения образуются
нанокомпозиты с содержанием серебра от
8 до 17 %. Соотношение нитрата
серебра, восстановителя и сополимера также влияет на концентрацию серебра в
нанокомпозитах.
В ИК-спектрах
полученных нанокомпозитов кроме сигналов исходных сополимеров других сигналов не обнаружено, что указывает
на неизменность структуры сополимера.
В УФ-спектрах водных
растворов полученных нанокомпозитов наблюдается характерная полоса плазмонного
поглощения с максимумом в области 400-408 нм (рис. 1). Вид спектров поглощения
и полуширина максимума свидетельствуют об образовании золей с изолированными наночастицами
серебра [8].

Рисунок 1. Характерный спектр поглощения водных
растворов нанокомпозитов серебра с винилацетатом, С = 10-4 моль/л.
Результаты
атомно-силовой и сканирующей микроскопии подтверждают получение нанокомпозитов
с равномерным узкодисперсным распределением наночастиц серебра в полимерной
матрице. Установлено, что в результате
образуются наночастицы сферической и эллиптической форм со средним
диаметром 51 нм. Распределение наночастиц по размерам представлено на рис. 2.
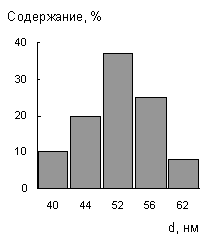
Рисунок 2. Распределение наночастиц серебра по
размерам в нанокомпозите на основе АГХ-ВА, полученного методом осаждения.
Исследования противомикробной активности показали,
что нанокомпозиты обладают антибактериальной активностью как в
отношении грам-позитивных, так и грам-негативных микроорганизмов. Причем бактерицидная активность нанокомпозитов
выше по сравнению с сополимером. Такая универсальность противомикробного действия нанокомпозитов на основе
сополимеров 2,2-диаллил-1,1,3,3-тетраэтилгуанидинийхлорида делает их перспективными для разработки новых водорастворимых антисептиков, в производстве
лекарственных препаратов и
биотехнологии.
Таким образом, были получены новые
водорастворимые устойчивые нанокомпозиты серебра и сополимеров 2,2-диаллил-1,1,3,3-тетраэтилгуанидинийхлорида
с винилацетатом. Установлено, что
полученные нанокомпозиты обладают высокой бактерицидной активностью.
СПИСОК ЛИТЕРАТУРЫ
1.
Помогайло А.Д.,
Розенберг А.С., Уфлянд И.Е. Наночастицы металлов в полимерах. М.: Химия, 2000.
672 с.
2.
Благитко
Е.М., Бурмистров В.А., Колесников А.П. и др. Серебро в медицине. Новосибирск:
Наука-Центр, 2004. 256 с.
3.
Крутяков
Ю.А., Кудринский А.А., Оленин А.Ю., Лисичкин Г.В. // Успехи химии. 2008. Т. 77.
№ 3. С. 242-269.
4.
Вегера
А.В., Зимон А.Д. // ЖПХ. 2006. Т. 79. № 9. С. 1419-1422.
5.
Воробьева
А.И., Сагитова Д.Р., Горбунова М.Н. и др. // Высокомолекуляр. соединения. 2007.
Т. 49Б. № 7. С. 1293-1298.
6.
Горбунова М.Н.,Ощепкова
Т.Е. // Высокомолек. соединения. Б. 2009. Т. 51. № 10. С.
1830-1835.
7.
Методы экспериментальной
химиотерапии, под ред. Г.Н.Першина. Москва, 1971.
8.
Карпов С.В., Слабко В.В. Оптические и фотофизические
свойства фрактально-структурированных золей металлов. Новосибирск: Изд-во СО
РАН, 2003. 265 с.
Работа поддержана грантом РФФИ (№ 14-03-00081-а) и программой Президиума РАН (№ 12-П-3-1009) «Фундаментальные науки-медицине».