Д.х.н. 1Цыганкова
Л.Е., д.х.н. 2Вигдорович В.И., асп. 2Морщинина И.В., д.х.н. 2Шель Н.В., к.х.н. 1Урядников А.А., к.х.н. 1Есина М.Н.
1 Всероссийский научно-исследовательский институт
использования техники и нефтепродуктов. Тамбов. Россия.
2 Тамбовский государственный университет имени Г.Р.
Державина,
Тамбов, Россия. E-mail: vits21@mail.ru.
Сорбция глауконитом катионов магния (II) из хлоридных растворов, содержащих
посторонние электролиты
Природные глинистые минералы и биопродукты
продолжительное время изучаются как сорбенты для очистки питьевых вод [1 - 5] и
эффективные биоиндикаторы [6] экологической чистоты биосферы. Не ослабевает к
ним интерес и в настоящее время [7, 8].
Целью настоящего сообщения явились результаты изучения
сорбции катионов Mg2+ 95%-м концентратом
глауконита Бондарского месторождения Тамбовской области (Россия) из модельных
хлоридных растворов и сред, содержащих дополнительно фиксированные количества Na2SO4 или KNO3. Стандартные растворы Mg2+ готовили растворением
металлического магния с содержанием основного вещества 99,94 масс.%.
Концентрация Mg2+ - 120 мг/л и менее (последовательное разведение).
Содержание Na2SO4 и KNO3 оставалось постоянным и
составляло 16,5 или 1,65 мМ сульфата натрия либо 5,0 или 0,5 мМ нитрата калия.
Сорбцию осуществляли из механически перемешиваемых непроточных сред с массой
сорбента 1, 2, 3 или 5 г/100 мл раствора.
Концентрацию Mg2+фиксировали
комплексонометрическим титрованием трилоном Б с индикатором эриохромом черным
Т. Оценивали коэффициент адсорбционного извлечения Mg2+ (ρ),
представляющий собою отношение разности концентрации катионов до и после
сорбции к их исходному содержанию. Эксперименты проведены при комнатной
температуре в воздушной атмосфере. Сорбент отмывали от исходных катионов
жесткости 3 М NaCl с переводом его в Na-форму, рН сред 5,8-5,9
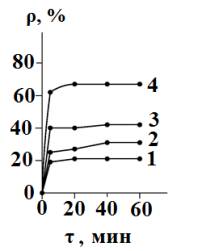
При сорбции из хлоридных растворов, не
содержащих посторонних электролитов, с исходной концентрацией 5 ммоль/л MgCl2 основная часть катионов
сорбируется в первые пять минут (рис. 1), а сорбционное равновесие достигается
за 20 минут. Величина ρравн зависит от используемой массы
сорбента m, но зависимость ρравн = f(mc)
не носит линейного характера.
|
|
Рис. 1. Зависимость величины ρ от массы
используемого сорбента и продолжительности сорбции. Исходная концентрация
магния 0,12 г/л. Объем раствора – 0,1 л. mсорб., г: 1 – 1; 2 – 2;
3 – 3; 4 – 5. |
Снижение вдвое исходного содержания Mg2+ позволяет достичь ρравн
порядка 88 %.
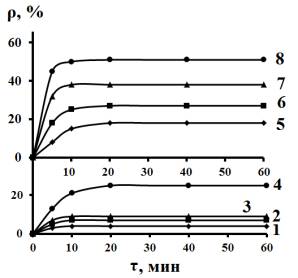
Введение 16,5 мМ Na2SO4 в 5 мМ растворы MgCl2 повышает их ионную силу
и существенно снижает величину ρравн (рис. 2), которая в
присутствии 5 г сорбента в 100 мл раствора составляет не более 25 %.
|
|
Рис. 2. Зависимость величины ρ от массы
используемого сорбента и продолжительности сорбции из 5,0 мМ растворов,
содержащих 16,5 мМ (1 -4) и 1,65 мМ (5 - 8) Na2SO4. Масса сорбента, г: 1
и 5 – 1; 2 и 6 – 2; 3 и 7
– 3; 4 и 8 – 5. |
Снижение вдвое концентрации MgCl2 при Ссульфата
= const повышает ρравн до 52 %. Подобное влияние
оказывает и введение KNO3, хотя в его присутствии
ионная сила раствора увеличивается много слабее, т.е. величина ρравн
определяется как концентрацией, так и природой постороннего электролита.
Оценка подчинения сорбции изотермам Фрейндлиха,
Темкина, Ленгмюра показала, что наиболее вероятна реализация процесса по
уравнению
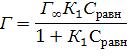
где
Г и Г∞ - удельная текущая и максимальная удельная адсорбция, К1
– константа адсорбционного равновесия. С учетом оценок Г∞ и К1
с использованием уравнения
ΔG = -RTlnК1,
получена
величина ΔGадс, а из зависимости
dГ/dτ = Kc(Г∞ – Гτ),
где
τ – время от начала процесса, Кс – константа скорости адсорбции.
Значение dГ/dτ найдено графическим
дифференцированием. Соответствующие данные приведены в таблице 1.
Таблица
1. Физико-химические параметры сорбции катионов Mg2+ концентратом глауконита
из фоновых растворов и сред, содержащих посторонний электролит.
|
Природа и концентрация индифферентного
электролита |
К1, л/моль |
Г∞, ммоль/г |
- ΔGадс, кДж/моль |
Кс, мин-1 |
|
Отсутствует |
1770 |
0,09 |
18,2 |
0,058 |
|
16,5 мМ Na2SO4 |
950 |
0,03 |
16,7 |
0,064 |
|
1,65 мМ Na2SO4 |
530 |
0,10 |
15,3 |
0,123 |
|
5,0 мМ KNO3 |
3330 |
0,02 |
19,7 |
0,044 |
|
0,5 мМ KNO3 |
610 |
0,11 |
15,6 |
0,067 |
Как следует из экспериментальных данных,
удельная адсорбция катионов Mg2+ на глауконите из
хлоридных растворов невелика. Однако, это компенсируется большими массами
имеющегося природного минерала, его экологической чистотой и в случае магния
отсутствием необходимости в десорбции катионов при замене сорбента в
технологических процессах.
Исследование проведено в рамках выполнения задания
Министерства образования и науки РФ № 2014/285 (проект №1501) на оборудовании
ЦКП «Нанохимия и экология» Тамбовского государственного университета имени Г.Р.
Державина.
Литература.
1. Тарасевич Ю.И., Овчаренко Р.Д. Адсорбция на
глинистых минералах. Киев. Наукова думка. 1975. 352 с.
2. Тарасевич Ю.И. Природные сорбенты в процессах
очистки воды. Киев. Наукова думка. 1981. 208 с.
3. Raupach M.,
Emerson W.W., Slade P.G // J. Colloid Interface Sci. 1979. V. 69. № 3. p. 408.
4. Barrer R.M.,
Towsend R.P. // J. Chem. Soc., Faraday Trans. I. 1976. V. 72. № 11. p.
2660.
5. Тарасевич Ю.И., руденко Г.Г., Кравченко В.А.,
Поляков // Химия и технология воды. 1979. Т. 1.
№ 1. С. 68.
6. Gonzalez A.G.,
Pokrovsky O.S. // J. Colloid Interface Sci. 2014. V. 415. № 2. p. 178.
7. Srivastava P.,
Singh B., Angove M. // J. Colloid Interface Sci. 1979. V. 69. № 3. p. 408.
8. Singh K.K.,
Rastoqi R., Hasan S.H. // J. Colloid Interface Sci. 2005. V. 290. № 1. p. 68.