Источники и пути образования оксида азота в организме
Г.Т.Куандыкова., Л.О Укибаева, Р.Т.Куандыкова
Таразский
государственный университет имени
М.Х.Дулати
Современные
представления о регуляции клеточных процессов позволяют особо выделить
некоторые химические соединения, обладающие полифункциональным физиологическим
действием. К числу таких соединений с полным основанием можно отнести оксид
азота. Данный свободный радикал способен оказывать как активирующее, так и
ингибирующее действие на различные метаболические процессы, протекающие в
организме млекопитающих и человека. Несмотря на многочисленные исследования,
значение оксида азота в системной регуляции гомеостаза клеток и тканей не
вполне понятно.
Оксид
азота (NO) - газ, хорошо известный химикам и физикам, в последнее
время привлек пристальное внимание биологов и медиков. Интенсивное изучение
биологического влияния NO началось с 80-х годов,
когда Р. Фуршготт и Дж. Завадски показали, что расширение кровеносных сосудов
под влиянием ацетилхолина происходит только при наличии эндотелия -
эпителиоподобных клеток, выстилающих внутреннюю поверхность всех сосудов.
Вещество, выделяющееся эндотелиальными клетками в ответ не только на
ацетилхолин, но и на многие другие внешние воздействия, приводящие к расширению
сосудов, получило название «сосудорасширяющий эндотелиальный фактор». Несколько
позже было доказано, что это вещество является газом NO и в клетках имеются
особые ферментные системы, способные его синтезировать.
По
своей химической структуре оксид азота относится к нейтральным двухатомным
молекулам. Благодаря наличию неспаренного электрона на внешней р-орбитали
молекула NO обладает высокой реакционной способностью и свойствами
свободного радикала.
В
организме человека и млекопитающих оксид азота главным образом образуется в
результате окисления гуанидиновой группы аминокислоты L-аргинина с
одновременным синтезом другой аминокислоты цитруллина под влиянием фермента NO-синтазы.
Фермент был назван синтазой, а не синтетазой, поскольку для его работы не
требуется энергия АТФ.
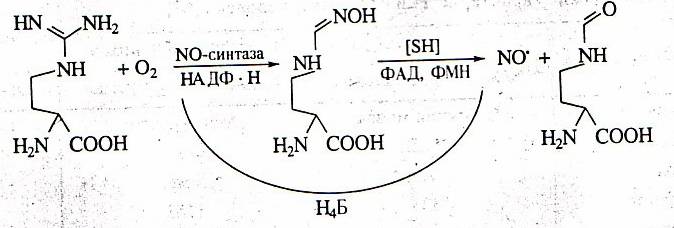
Рис.
1. Схема синтеза окиси азота из L-аргинина
Кроме
L-аргинина NOS может использовать в
качестве субстратов гомоаргинин, аргиниласпарагин, метиловый эфир аргинина,
гуанидинотиолы. При недостатке субстрата в клетках или Н4Б фермент
начинает восстанавливать кислород до супероксид радикала и перекиси водорода.
Такие условия могут быть следствием как нарушения транспорта аминокислоты (в
некоторых тканях она не синтезируется), так и недостатка в пище, поскольку
синтез L-аргинина при этом в организме не увеличивается.
В
живой ткани SH-содержащие белки, пептиды и аминокислоты образуют такие
парамагнитные аддукты общего состава Fe(NO)2(SR)2,
спектры ЭПР которых являются ассиметричными вариацией g-фактора от 2.01 до
2.05. однако из-за большого разнообразия естественных акцепторов NO и
вариабельности их содержания, количественное определение этого радикала таким
образом вряд ли возможно. В то же время гемопротеиды (гемоглобин, миоглобин,
цитохром а3 и др.) образуют нитрозильные парамагнитные комплексы,
имеющие широкий спектр ЭПР.
С
разрешенной сверхтонкой структурой (СТС) в области значений g-фактора
меньше 2. Анализ полученных спектров ЭПР свидетельствует о том, что структура
указанных комплексов имеет ромбическую симметрию.
Таблица
1. прямые методы регистрации оксида азота.
|
Инструментальный метод |
Соединение-индикатор/реакция-индикатор |
Чувствительность |
|
ЭПР |
Fe-(NO)2-(SR)2 |
|
|
ЭПР |
Hb-Fe(II)-NO |
5 мкМ |
|
ЭПР |
(ДТК)2-Fe(II)-NO |
1 мкМ |
|
ЭПР, L-линия |
Фьюзинит-NO |
1 мкМ |
|
Хемилюминесценция |
NO + O3 = hн + NOx |
20 нМ |
|
Амперовольтметрия |
NO + e = NOx |
10 нМ |
Более
перспективным представляется метод с использованием карбоксигемоглобина в
качестве экзогенной спиновой ловушки оксида азота. На состояние Hb-Fe(II)-CO
не оказывает влияния степень оксигенации среды, а поскольку прочность
связывания NO с гемоглобином на три порядка больше, чем прочность
связывания СО, то можно ожидать практически количественного образования
нитрозил-гемоглобина. Следует, однако, отметить, что гемоглобин или его
производные имеют ряд особенностей, ограничивающих применение их в качестве
естественной или экзогенной спиновой ловушки. Проникновение крупных молекул в
клетки к месту синтеза оксида азота крайне затруднено, поэтому включаться в
комплекс и становиться ЭПР-видимой будет лишь часть оксида азота, не
метаболизированная в период диффузии. Кроме того, недостаточно определены пути
и скорости дальнейших превращений Hb-Fe(II)-NO в
живой клетке.
При
прямом определении NO методом ЭПР-спектрометрии перспективным
представляется использование в качестве спиновой ловушки производных
дитиокарбаминовой кислоты (ДТК). В организме они образуют ЭПР-видимые комплексы
состава (ДТК)2-Fe-NO,
включающие в себя «свободное» железо. Эти комплексообразователи позволяют
изучать образование оксида азота в тканях животных, в гомогенах, в культуре
клеток и биологических жидкостях. Важно, что при оптимальных нетоксичных
концентрациях ДТК их высокая скорость взаимодействия с NO существенно снижает
вероятность реакции оксида азота с другими биомолекулами, в том числе с
радикалами, и тем самым ограничивает влияние этих реакций на результаты
ЭПР-спектрометрии.
Предложен
оригинальный метод ЭПР-дозиметрии NO, в котором применена
спиновая макроловушка - фьюзиниты. Это частицы размером 10 мкм, выделяемые из
угля. Они обладают способность поглощать оксид азота с изменением характеристик
собственного ЭПР-спектра. Не подвергаясь метаболизму, они не оказывают
токсического действия на клетки, и после поглощения путем фагоцитоза могут быть
использованы в качестве аналитического средства, специфического к оксиду азота.
Наиболее
чувствительным среди методов определения NO в организме или в
клеточных системах является электрохимический метод. Он основан на
каталитическом окислении оксида азота полимерным металлопорфирином
(полупроводником n-типа), которое протекает при 630 мВ. Диаметр
электрода может достигать 0,2 мкм, что позволяет измерять внутриклеточное
производство оксида азота. Поскольку время ответа электрода составляет около 10
мс, часть радикалов, вступающая в очень быстрые реакции (например, с
супероксид-радикалом), не может быть зарегистрирована. С помощью этого методы
были проведены измерения содержания оксида азота в крови человека.
Хемилюминесцентный
метод основан на регистрации фотонов, излучаемых в реакции NO с
озоном. Несмотря на высокую чувствительность, применение его к биологическим
объектам затрудняется сложным этапом доставки радикала в анаэробную газовую
фазу. Кроме того, на выход люминесценции оказывают влияние аммиак, олефины,
окислы серы и другие продукты, выделяющиеся в результате биологической
активности организма и часто содержащиеся в стенках аппаратуры.
Среди
непрямых методов определения NO (таблица 3) наиболее
распространенным методом оценки его синтеза является реакция на нитрит-анион с
использованием реагента Грисса (раствор сульфаниламида и N-(1-нафтил)
-этилендиамида в 2,5%-ной ортофосфорной кислоте), которая дает окрашенный
дазопродукт с максимумом поглощения при 548 нм. Обычно отношение содержания NO-2/NO-3 у млекопитающих
составляет 1 : 10. и хотя содержание нитрит-аниона менее подвержено влиянию
состава питания, при необходимости более полного определения продукции оксида
азота измеряют и содержание нитрат-аниона. Для этого NO-3, выделяющийся в культурную
среду или биологические жидкости, восстанавливают металлическим кадмием,
импрегнированным медью, или ферментативно, нитратредуктазой.
Таблица
2. косвенные методы определения оксида азота [1].
|
Соединение-индикатор |
Принцип определения |
Метод регистрации,
чувствительность |
|
Метгемоглобин |
Hb-Fe(II)-O2 + NO = =Hb-Fe(III) + NO-2 |
Фотометрия, 2 нм |
|
Иминонитроксид (ИН) |
Нитронил нитроксид+NO
= =ИН |
ЭПР |
|
Нитрит-анион |
NO-2
+ реагент Грисса = диазопродукт |
Фотометрия, 1 мкм |
|
Нитрит-анион |
ФТИО* + NO = NO-2 |
То же |
|
Нитрат-анион |
NO-3 + Cd = NO-2 NO-3 + нитратредуктаза = =NO-2 |
То же |
|
Нитрит-анион |
NO-2 + S2O-4 = NO+Hb-Fe(II) = Hb-Fe(II)-NO |
ЭПР, 1 мкм |
|
Цитруллин |
3H-L-аргинин
+ NOc = 3H-L-цитруллин |
ВРЖХ, радиометрия; 0,1
мкм |
|
цГМФ |
NO
+ 3Н-ГМФ + ГЦ = =3Н-цГМФ |
Хроматграфия, радиометрия |
|
бис-Формазан (БФ) |
ТНС* + NOc
+ НАДФ.Н = =БФ |
Гистохимия |
|
НАДФ.Н |
НАДФ.Н + L-аргинин
+ NOc = НАДФ.Н |
Флуорометрия |
* ФТИО -
2-(4-карбокифенил)-4,4,5,5-тетраметилимидазолин-3-оксид-1-оксил;
ТНС
- тетразолий нитросиний;
ГЦ
- гуанилатциклаза.
Высокую
чувствительность имеет метод, основанный на фотометрии метгемоглобина,
образующегося в результате окисления оксигемоглобина NO. Применения
двухволновой спектрофотомерии дает возможность определять до 2 нМ оксида азота.
В качестве субстратов также могут быть использованы дезокси- и
карбоксигемоглобин. Серьезным недостатком, ограничивающим применение этих
методик, является необходимость очистки исследуемых объектов от эндогенного
гемоглобина, а также соединений, способных его окислять.
Как
известно, оксид азота образуется из L-аргинина в эквимолярном
отношении с L-цитруллином. На этом основан радиометрический метод
определения NO по появлению L-цитруллина, меченного
радиоактивной меткой, происходящей из L-аргинина. В
определенных условиях для оценки синтеза цитруллина может быть полезной
колориметрическая реакция на карбаминогруппу. Другой необходимый компонент
синтеза NO - НАДФ.Н. разница в скорости его окисления в
присутствии и в отсутствии ингибитора NO-синтазы может служить
показателем синтеза NO. Подобный метод применяется в
гистохимии, где регистрируется НАДФ.Н-зависимая диафоразная
активность NO-синтазы в присутствии и в отсутствии ее ингибиторов.
В
качестве показателя синтеза NO в клеточных экстрактах
также используется универсальная способность этого радикала увеличивать
активность гуанилатциклазы в 10-50 раз. Ряд методов основан на измерениях
физиологических реакций, инициируемых NO, таких как релаксация
сосудов, ингибирование адгезии тромбоцитов и др.
Некоторые
производные NO также проявляют NO-подобную
физиологическую активность, поэтому помимо биотестов были предложены
инструментальные методы их определения (хемилюминесценция с предварительным
фотолизом образцов).
Участие
нитропроизводных (производных нитритов и нитратов) во многих патологических
процессах, в том числе и опухолевом росте, было известно давно. Первоначально
разрозненные и часто необъяснимые данные о связи противомикробного и
противоопухолевого действия макрофагов и нитропроизводных прояснились после
открытия синтеза NO в эндотелиальных клетках. Действие
макрофагов на чужеродные агента также стали связывать с NO,
и многочисленные эксперименты подтвердили, что макрофаги способны синтезировать
NO-синтазу и выделять большое количество газа. Уже отмечалось,
что NO-синтаза макрофагов является индуцибельным ферментом. В
нормальных условиях клетки не содержат этот фермент и не продуцируют NO.
Под влиянием липополисахаридов микробного происхождения или цитокинов -
высокоактивных межклеточных посредников, выделяющихся, в частности, лимфоцитами
при их контакте с чужеродными агентами, в макрофагах начинается синтез
индуцибельной изоформы NO-синтазы, образующей
большой объем NO, оказывающего, в свою очередь, цитостатическое и
цитолитическое действие на бактериальные и чужеродные (в том числе и раковые)
клетки.
Нейтрофилы
также способны экспрессировать индуцибельную форму NO-синтазы и синтезировать
NO, однако данные о цитотоксическом действии этих клеток,
связанном с NO, неизвестны.
Известно,
что нейтрофилы и макрофаги способны активно образовывать свободные радикалы
кислорода, и, возможно, образование пероксинитрита в реакции NO
со свободными радикалами может усиливать антимикробный эффект этих клеток.
Роль
оксида азота в развитии патологических состояний
Токсический
эффект NO проявляется прежде всего в ингибировании митохондриальных
ферментов, что приводит к снижению выработки АТФ, а также ферментов,
участвующих в репликации ДНК. Кроме того, NO и пероксинитрит могут
непосредственно повреждать ДНК, это приводит к активации защитных механизмов, в
частности стимуляции фермента поли(АДФ-рибоза)синтетазы, что еще больше снижает
уровень АТФ и может приводить к клеточной гибели. Повреждение ДНК под влиянием NO
является одной из причин развития апоптоза, особого вида клеточной смерти,
регулирующейся геномом клетки.
Следует
отметить еще одно интересное наблюдение, связанное уже с нейронами, содержащими
NO-синтазу, и не получившее пока полного объяснения. Еще в
60-х годах Е. Томас и Э. Пирс использовали новый гистохимический метод
выявления активности фермента НАДФН-диафоразы (фермент, способный
восстанавливать окисленную форму НАДФ) для анализа нервной системы и показали,
что в разных отделах головного мозга имеются единичные нейроны с интенсивной
положительной реакцией. Эти нейроны, которые получили название «одиночные
активные клетки», остаются неповрежденными при разнообразной патологии нервной
системы, в то время как большинство других клеток погибает. Относительно
недавно выяснилось, что НАДВН-диафоразная активность свойственна NO-синтазе,
и, таким образом, была установлена устойчивость нейронов, содержащих NO-синтазу,
к разнообразным патологическим воздействиям. Механизмы такого необычного и
имеющего большое биологическое значение свойства клеток окончательно не
выяснены.
Остается
не выясненным и вопрос о том, почему большие дозы синтезированного газа не
оказывают токсического воздействия на клетки, в которых они образуются. Одним
из возможных объяснений такого парадокса может быть то, что в нейронах,
содержащих NO-синтазу, определяется высокая активность фермента
супероксиддисмутазы, катализирующей распад токсических радикалов и защищающей
клетку от губительного действия.
Результаты
последних исследований позволили предположить, что активация NO-синтазы
может выполнять не только положительную роль, но и оказывать повреждающее
действие на клетки. Это связано с разнонаправленным действием механизмов,
опосредующих эффекты NO, в результате чего
ответ клетки на один и тот же стимул может быть существенно разным.
Примерами
токсического действия NO являются основные нейродегенеративные
заболевания ЦНС, такие как ишемический инсульт, эпилепсия и другие судорожные
расстройства, болезни Паркинсона и Альцгеймера, боковой ангиотрофический
склероз и т.д. В основе развития этих расстройств лежит избыточная продукция
оксида азота в результате гиперактивации глутаматных рецепторов NMDA-подтипа,
ведущей к повышению содержания внутриклеточного кальция и активации NO-синтазы.
Также
выявлено участие оксида азота в развитии инсулинозависимого диабета, при этом
непосредственной мишенью действия NO и других свободных
радикалов является ДНК в-клеток островков Лангерганса.
Избыточная
продукция NO индуцибельной формой NO-синтазы - важное звено
в патогенезе острой недостаточности кровообращения при тепловом, кардиогенном,
септическом и других видах шока.
В
то же время, действие ряда факторов (липопротеины низкой плотности, высокие
концентрации глюкозы и ишемия) может вызывать снижение продукции NO
как за счет ингибирования NO-синтаз, так и за счет
снижения их экспрессии. При этом низкий уровень оксида азота приводит к
повышению тонуса сосудов, свертываемости крови и снижению иммунитета, тем самым
способствуя развитию гипертензии, атеросклероза, тромбозов, ишемической болезни
сердца, инфекционных заболеваний и опухолевого роста.
Таким
образом, возникает необходимость в модулирующем воздействии на системы
генерации NO c тем, чтобы поддержать
или усилить защитное и физиологическое действие NO и, в то же время,
устранить или ограничить его повреждающие эффекты. По последним данным, эффекты
оксида азота зависят не только от концентрации, но также от места его
продукции, диффузии в клетках и тканях, образования NO-содержащих соединения,
взаимодействия с реактивными формами кислорода (в особенности с
супероксид-анион радикалом) и, возможно, от других факторов.
Таким
образом, для понимания процессов, лежащих в основе перехода защитных эффектов
этого агента в повреждающие, а также для выработки новых стратегий лечения
необходимо установить роль этих факторов в проявлении биологической активности NO.
Таким
образом, образование NO при ферментативном
окислении L-аргинина является уникальным биохимическим феноменом.
Эксперименты на животных показали его чрезвычайно важную роль в регуляции
сосудистого тонуса, активности тромбоцитов и лейкоцитов, нейропередаче и нейромодуляции,
в обеспечении толерантности организма к патогенам. Некоторые из этих функций NO
начинают успешно использоваться в терапии ряда заболеваний легких, сосудов,
мозга. Применение уже известных фармакологических средств и разработка новых
для воздействия на физиологические и патофизиологические процессы, опосредуемые
оксидом азота, несомненно, приведет к значительному прогрессу в лечении таких
распространенных заболеваний, как атеросклероз, гипертония, диабет и др. Кроме
того, следует учитывать биологические явления, связанные с NO,
при изучении побочных эффектов традиционных терапевтических препаратов, а также
вновь разрабатываемых средств для применения в иных областях медицины.
Открытие
высокоактивного межклеточного посредника - NO позволило прояснить
многие неясные вопросы жизни клеточного сообщества в организме человека и
животных. В 1992 году NO в знак большого
интереса к ней исследователей был назван молекулой года. В 1998 году Р.
Фуршготт, Л. Игнарро и Ф. Мурад за работы по выяснению механизмов, связанных с
участием NO, получили высшую оценку мировой науки - Нобелевскую премию.
Однако, как это всегда бывает на пути познания, новое порождает еще больше
вопросов. По-видимому, NO еще долго будет
привлекать внимание исследователей, и можно надеяться, что будут получены новые
интересные и значимые результаты.
Список
используемой литературы
оксид азот синтаза фермент
1. И.П. Серая, Я.Р.
Нарциссов «Современные представления о биологической роли оксида азота».
Межрегиональный институт цитохимии, Москва, 2002г.
2. О.Ю.
Колесниченко, Л.М. Филатова, З.А. Кривицина, Ю.И. Воронков «Эндотелиальная
дисфункция и метаболические эффекты оксида азота у человека», 2003г.
3.Н.А.
Виноградов «Антимикробные свойства окиси азота и регуляция ее биосинтеза в
макроорганизме». Центральный НИИ эпидемиологии, Москва.
4. Брюне
Б., Сандау К., Кнетен А. // Биохимия. - 1988.- Т. 63, №7. - С. 966-975.
5. Малкоч А.В., Майданник
В.Г., Курбанова Э.Г. «физиологическая роль
оксида азота в организме
(Часть 1). <http://www.dialvsis.ru/magazin/1_2_2000/no1.htm>
6. Реутов
В.П., Сорокина Е.Г., Охотин В.Е., Косицын Н.С. «Циклические превращения оксида
азота в организме млекопитающих». М.: Наука, 1998. С. 156.
7. Малышев
И.Ю., Манухина Е.Б. //Биохимия. 1998. Т.63. С.870.
8. Албертс
А., Брей Д., Льюис Р. и др. «Молекулярная биология клетки: в 3 т.:
Пер. с англ. 2-е изд. М.: Мир, 1994.