Химия и химические технологии
Циклопропанирование транс-1-фенилбутена-2
Этилдиазоацетатом
Ахмедов Э.Н. 1, Рамазанов Г.А. 1,
Гулиев А.М. 2
1Сумгаитский Государственный Университет
2Институт Полимерных Материалов НАНА, г.Сумгайыт
Реакция этилдиазоацетата (ЭДА) с такими
разветвленными алкенами, как 1-метил-1-трет-бутилэтилен, 4-н-пропилгептен-3 и
2,4-диметил-3-изопропилпентен-2 проводилась в работе [1]. Установлено, что
реакция с первыми двумя олефинами, проведенные при t=100-110°С и 8-кратном
избытке олефина в присутствии Cu+2 –катализаторов приводит
к получению соответствующих эфиров циклопропанкарбоновых кислот с выходами 63 и
56 %. В случае же реакции с 2,4-диметил-3-изопропилпентен-2, несмотря на
большую нуклеофильность двойной связи, выход целевого продукта соответствует
только 14%, что авторы объясняют пространственной недоступностью реакционного
центра.
В реакцию присоединения ЭДА были вовлечены и
другие олефины [2], диены [3] и даже ацетиленовые углеводороды [4]. Как
правило, во всех случаях эта реакция протекала по электрофильному присоединению
и сопровождалась образованием циклопропановых соединений. Обычно реакция
присоединения ЭДА осуществляется либо нагреванием реагентов до температуры
100°С (термический способ), либо при более низких температурах в присутствии
каталитических количеств солей меди. Естественно, механизм этих реакций определяется
условиями их осуществления.
В присутствии катализаторов имеет место карбенный механизм реакции,
заключающийся в одностадийном присоединении алкоксикарбонилкарбена,
генерируемого каталитическим разложением ЭДА:
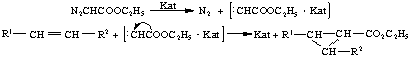
Характерными
особенностями этой реакции являются:
–
образование в качестве побочных продуктов эфиров фумаровой и малеиновой кислот
[5].
![]()
–
цис-стереоспецифичность реакции присоединения карбена к двойной связи олефина,
обусловленное синглетным состоянием углеродного атома в этоксикарбонилкарбене
(сохраняется исходная конфигурация алкена).
–
карбен проявляет электрофильный характер и присоединяется к более нуклефильным
центрам, где электронная плотность больше, [6].
При термическом разложении ЭДА реакция протекает
по механизму 1,3-биполярного циклоприсоединения и приводит вначале к
образованию пиразолина, распадающегося далее с образованием производных
циклопропана.
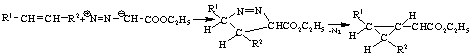
В
отличие от реакции, протекающей через
образование карбена, при термическом разложении ЭДА не образуются эфиры
малеиновой и фумаровой кислот.
В данной работе мы осуществили реакцию ЭДА с
1-фенилбутен-2 (ФБ), полученным в результате реакции гидрирования
4-фенилбутадиена-1,3:
![]()
Реакция ФБ с ЭДА проводили в каталитических условиях
в присутствии безводного CuSO4. Реакцию проводили в мольном соотношении ЭДА: ФБ=1:7.
Известно, что во всех реакциях присоединения
алкоксикарбонилкарбенов по двойной связи алкена образуются продукты, состоящие
из смеси двух цис- и транс- стереоизомеров [7]. Поскольку
используемый ФБ является смесью двух геометрических цис- и транс- изомеров,
то в результате реакции следовало ожидать образования всех четырех стереоизомеров:
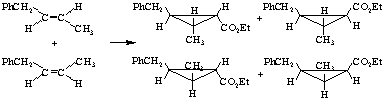
Хроматографический анализ продуктов реакции
показал, что действительно в результате реакции присоединения ЭДА к ФБ
образуются всевозможные продукты, разделение которых на индивидуальные
компоненты нам не удалось. Поэтому в дальнейшем реакцию присоединения ЭДА к ФБ
мы осуществили только с одним из
изомеров – ФБ. Эта реакция протекает по
нижеприведенной и общепринятой схеме:
![]()
![]()
Хроматографический анализ продуктов реакции
присоединения ЭДА к транс-ФБ показал
образование только двух соединений, ректификацией которых были получены фракции,
содержащие различные количество этих продуктов. Элементный анализ показал, что
выделенные фракции имеют одинаковый элементный состав, что свидетельствует о
том, что они являются изомерными продуктами (табл.1).
Таблица 1.
Элементный
состав фракций смеси стереоизомеров этиловых эфиров
2-бензил-3-метилциклопропанкарбоновых-1 кислот
|
№ |
Состав фракций* |
С** |
Н** |
|
1 |
75:25 |
76.83 |
8.06 |
|
2 |
66:34 |
76.67 |
8.12 |
|
3 |
51:49 |
77.00 |
8.00 |
|
4 |
43:57 |
76.92 |
7.94 |
* – по данным
хроматографического анализа
** – по теории С=77.06 %; Н=8.26 %.
Перегонкой
в вакууме на колонке удалось выделить с выходом 78
% фракцию с tкип.=138-142°C/6
мм.
Данные элементного анализа (С–76.95%, Н–8.21%)
соответствуют составу моноаддукта ЭДА с ФБ. Аналогичные результаты были
получены при проведении реакции присоединения в термических условиях. Следовательно, независимо от конкретного
механизма реакции транс-ФБ с ЭДА,
можно было ожидать образование смеси двух цис-
и транс- стереоизомеров, а именно –
этиловых эфиров циклопропанкарбоновых кислот с метильным и бензильным
заместителями в цикле:
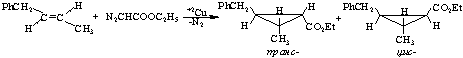
Сопоставление ПМР-спектров стереоизомеров, а
также использование некоторых литературных данных относительно 3-замещенных
циклопропанов позволили произвести отнесение геометрических изомеров. Следует
подчеркнуть, что установление цис- и транс- структуры эфиров бензил-метилциклопропанкарбоновых кислот в
смеси изомеров методом ПМР-спектроскопии несколько затруднено из-за усложнения
спин-спинового взаимодействия протонов цикла. По этой причине оценить в смеси
продуктов реакции долю какого-либо стереоизомера становится почти невозможным.
С целью идентификации цис- и транс- изомеров
вначале была осуществлена реакция эпимеризации смесей хлорангидридов
соответствующих цис- и транс- циклопропанкарбоновых кислот.
Известно, что хлорангидриды циклопропанкарбоновых кислот, имеющие цис- форму, при нагревании переходят в
более термодинамически устойчивую форму – в транс-
изомер. Методом ГЖХ-анализа было показано, что при нагревании в растворе диоксана
смеси цис- и транс- форм соответствующих хлорангидридов до 100°С имеет место
переход одного изомера (цис- изомера)
в другой (транс- изомер). Затем
действием этилата натрия были получены исходные эфиры, которые были затем
подвергнуты хроматографическому анализу. Из приведенных на рисунке 1
хроматограмм следует, что при попытке проведения реакции эпимеризации со смесью
изомеров не удалось заметить существенного изменения относительных площадей
пиков хроматограммы (хотя все же какое-то изменение происходит), что,
по-видимому, объясняется малым различием свободных энергий изомеров, содержащих
заместители у всех углеродных атомов цикла. Однако, это различие достаточно для
проявления некоторой избирательности на стадии образования, что отражается в
некотором преобладании одного из изомеров, а конкретно – транс-изомера. Поскольку присоединение этоксикарбонилкарбена должно
приводит к преимущественному образованию изомера с транс- расположением заместителей в цикле, то веществу 1 из показаний
хроматограммы должна отвечать транс-структура,
а веществу 2 – цис-структура.
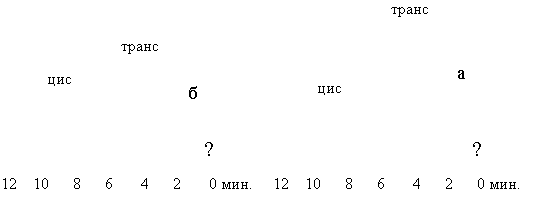

Хроматограммы этилового
эфира 2-бензил-3-метилциклопропанкарбоновой-1 кислоты: а - до реакции
эпимеризации, б - после реакции эпимеризации (н/ф – 10% ТЦЭП, носитель –
хромосорб «F», Т=130°С, VHe=50 мл/мин)
Для устранения ошибок в оценке относительных
выходов изомеров (вследствие возможной непропорциональности потерь в процессе
выделения индивидуальных изомеров из реакционной смеси) были поставлены
специальные опыты взаимодействия ФБ с ЭДА как в присутствии катализатора CuSO4 при 60°С
(каталитический метод), так и в отсутствии катализатора при 100°С (термический
метод), причем реакционная смесь непосредственно подвергалась анализу методом
ГЖХ без каких либо предварительных операций. Таким образом, удалось показать,
что, независимо от условий проведения реакции транс-ФБ с ЭДА, образуются оба изомера, структура которых доказана,
в основном, спектроскопическими методами.
Эти изомеры были выделены в индивидуальном виде
и охарактеризованы. В ИК-спектрах обоих аддуктов-стереоизомеров имеются полосы
поглощения при 1720 см-1, соответствующие валентным колебаниям
карбонильной группы, 1040 см-1,
характерные для скелетных колебаний СН2-групп в
трехуглеродном цикле, 1600 см-1, относящиеся к фенильной группе. Эти
данные полностью согласуются со структурой стереоизомеров, однако не дают
возможность сделать выводы о геометрическом расположении заместителей.
Сопоставление ПМР-спектров стереоизомеров,
выделенных в чистом виде, и с использованием литературных данных относительно
ПМР-спектров замещенных циклопропанов позволило нам произвести отнесение
геометрических изомеров (табл.2).
Таблица 2.
Данные ПМР-спектров
стереоизомеров 2-бензил-3-метилциклопропан карбоновых-1 кислот
|
Стереоизомер (шифр) |
Ph |
Ph-CH2- |
-OCH2- |
-C-CH3 |
Hα |
Hβ |
Hγ |
|
|
транс- |
7.20м. |
2.35д. |
4.0 кв. |
1.1 тр. |
1.10-1.85 м. |
0.95-1.10 м. |
1.85-2.25 м. |
1.0 с. |
|
цис- |
7.22м. |
2.68д. |
4.05кв. |
1.1 тр. |
0.9-1.85 м. |
1.10-2.10 м. |
1.90-2.10 м. |
1.05 с. |
Принимая во внимание то, что карбонильная группа
(в кислотах, сложных эфирах, кетонах) дезэкранирует цис-протон цикла, а метильная группа экранирует цис-протон цикла, мы произвели отнесение
изомеров [7].
Из ПМР-спектров следует, что протоны Нγ
в транс-изомере и Нβ в
цис-изомере находятся в цис-положении относительно карбонильной
группы (сложноэфирного фрагмента). Следовательно, они дезэкранируются и поэтому
проявляются в относительно слабых полях. Протоны же Нγ в транс-изомере, Нα и Нγ
в цис-изомере попадают под экранирующее
влияние метильной группы и потому резонируют в относительно сильных полях.
Синглетные сигналы протонов метильной групп, связанные с углеродным атомом
трехчленного цикла резонируют при δ=1.0 м.д.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез
этиловых эфиров 2-бензил-3-метилциклопропанкарбоновых-1 кислот.
Синтез этиловых эфиров
2-бензил-3-метилциклопропанкарбоновых кислот осуществляли взаимодействием транс-ФБ с ЭДА в каталитических условиях
в присутствии безводных солей меди (сернокислой или хлористой) по следующей
методике:
![]()
В трехгорлую колбу емкостью 1 л, снабженную
механической мешалкой, обратным холодильником с отводом в газометр и капельной
воронкой, помещали около 0.5 г безводного CuSO4, 3.0÷5.0 г-моль
свежеперегнанного ФБ, 100 мл гептана. Колбу вначале продували азотом, а затем
нагревали на водяной бане до 60°С и при перемешивании медленно прикапывали 1.0
г-моль этилдиазоацетата в течение 6-8 часов. За ходом реакции следили по
выделению свободного азота. По окончании прибавления всего этилдиазоацетата
реакционную массу нагревали при той же температуре еще 1 час до полного
прекращения выделения азота. Смесь охлаждали до комнатной температуры и
отбирали пробу для ГЖХ-анализа. Гептан отгоняли из реакционной смеси при
нормальной давлении, а избыток исходного олефина и остаток перегоняли в
вакууме. Отдельной фракцией были выделены замещенные этоксикарбонилциклопропаны
в виде смеси двух геометрических изомеров. Полученные соединения имели
следующие показатели: Тк=138-142°С/6 мм; nD20=1.5210; d420=1.0390; MRD=63.81 (выч.63.88).
Синтез
2-бензил-3-метилциклопропанкарбоновых-1 кислот.
![]()
Смесь 0.1 г-моль этилового эфира
2-бензил-3-метилциклопропанкарбоновой кислоты в 60 мл абсолютного этилового
спирта и 0.4 г-моль едкого кали нагревали при 60°С в течение 5 часов. После
реакции избыток спирта отгоняли, остаток разбавляли водой, подкисляли
концентрированной соляной кислотой. Органическую часть отделяли, а водный раствор
несколько раз экстрагировали серным эфиром. Эфирные вытяжки объединяли, сушили
прокаленным Na2SO4, затем отгоняли эфир на
водяной бане, а остаток перегоняли в вакууме. Полученные соединения имели
следующие константы: Тк=150-153/4 мм; nD20=1.5340;
d420=1.0902; MRD=54.20
(выч.54.15).
Синтез
хлорангидридов 2-бензил-3-метилциклопропанкарбоновой-1 кислоты.
![]()
К растворенному в петролейном эфире 0.1 моль
2-бензил-3-метилциклопропанкарбоновой кислоты приливали 0.24 моль
тионилхлорида. Температуру реакционной среды поддерживали на уровне 0-5°С.
Смесь выдержали в колбе с хлоркальциевой трубкой в течение 24 часов, после чего
удаляли петролейный эфир с помощью вакуума водяного насоса. Остаток перегоняли
в вакууме маслонасоса. Полученный хлорангидрид 2-бензил-3-метилциклопропанкарбоновой
кислоты имел следующие константы: Тк=125-127/2 мм; nD20=1.5430; d420=1.1492; MRD=57.43 (выч.56.82).
Идентификация
стереоизомерных форм этиловых эфиров 2-бензил-3-метилциклопропанкарбоновой-1
кислоты методом эпимеризации.
Эпимеризация хлорангидридов. 2 мл хлорангидрида
смеси изомеров 2-бензил-3-метилциклопропанкарбоновой кислоты в атмосфере
инертного газа (аргон или азот) поместили в ампулу, запаяли и выдерживали в
термостате при температуре 130°С в течение 14 часов. Ампулу охлаждали,
вскрывали и добавляли 10 мл абсолютного этанола. Полученную смесь для
превращения в этиловый эфир кипятили на водяной бане в течение 5 часов. После
отгонки избытка спирта продукты хроматографировали.
Эпимеризация эфиров. Исходную смесь изомеров эфиров
2-бензил-3-метилциклопропанкарбоновой-1 кислоты (0.1 г-моль) в абсолютном
этаноле (25 мл) добавляли к раствору этилата натрия в абсолютном этаноле (50
мл). Полученный раствор в атмосфере аргона помещали в ампулу, запаивали и
нагревали при 80°С в течение 4 суток. Затем ампулу охлаждали и вскрывали.
Продукты эпимеризации подвергали хроматографическому анализу. Идентификация
стереоизомеров была осуществлена сопоставлением хроматограмм исходной смеси
изомеров и продуктов эпимеризации. Полученные данные приведены ниже.
|
Соединение |
Способ проведения эпимеризации |
Содержание эфиров в исходном эфире (%) |
Содержание изомеров после реакции эпимеризации
(%) |
||
|
Транс- |
Цис- |
Транс- |
Цис- |
||
|
Этиловый
эфир 2-бензил-3-метилциклопропанкарбоновой-1
кислоты |
Эпимеризация хлорангидрида Эпимеризация
эфиров |
51 51 |
49 49 |
56 62 |
44 38 |
ЛИТЕРАТУРА
1.
Мищеряков А.П., Долгий И.Е., Манаков М.Н., Гайворонская Г.К.. Взаимодействие диазоуксусного
эфира с разветвленными алкенами. // Изв.АН СССР. Сер. Хим. 1966, С.1235-1240
2. Maas G. Ruthenium-catalyzed cyclopropanation
reactions with diazo compounds. // Chem.Soc.Rev.2004, v.33, p.183-190
3.
Гулиев А.М., Лишанский И.С., Померанцев В.И., Туркова А.Д. Синтез и
установление структуры аддуктов карбена с цис-
и транс-пентадиеном-1.3. // Ж. орг.
химии, 1970, № 5, с. 918
4.
Шапиро Е.А., Дяткин А.Б., Нефедов О.М. Синтез и карбенное разложение функциональнозамещенных
эфиров диазоуксусной кислоты.// Изв.АН
СССР, Сер.хим. 1991, № 5, с.1051-1056
5. March J. Advanced Organic Chemistry: Reactions,
Mechanisms and Structure. 4th ed. John Willey & Sons: New York,
1992.
6. Химия карбенов. О.М.Нефедов, А.И.Иоффе, Л.Г.Менчиков./ М.:Химия, 1990, 304 с. С.177-192
7. Lebel H., Marcoux J.F., Molinaro c.,
Charette A.B. Stereoselective cyclopropanation reactions. // Chem.Rev.- 2003,
v.103, N 3, p.977-1050