К.х.н. доцент Мазова О.В., Гербер Н.И.,
Зюзина Э.В., Цибульникова А.В.
Балтийский федеральный университет им. И.Кант, Калининград, Россия
Синтез
некоторых гибридных органолюминофоров
хинонофенотиазинилированной структуры
В
настоящее время широко изучаются реакции, связанные с созданием органических
макромолекулярных структур. Представляют интерес соединения на основе фенотиазина и различных хинонов. Известные оксиредуктоны п-бензохиноны играют
важную роль в переносе электронов в фотосинтезирующих цепях биологически
активных систем. К
наиболее перспективным фотохромным соединениям относятся системы, в
которые включены гидрокси-, арил- и аминогруппы. NH-замещенные
фенотиазинилированные циклы обладают биологической активностью с широким
спектром. [1]. У
орагнолюминофоров процессы поглощения и излучения света протекают в пределах
каждой способной люминесцировать молекулы. Люминесценцией обладает лишь небольшая группа соединений-ароматические и
гетероциклические. Так, производные антрахинона, содержащие имино- и
гидроксигруппы, обладают флуоресцентными свойствами. Спектральные свойства антрахинонового ядра изменяются в результате аннелирования его
гетареном. [2]. Органолюминофоры
возможно использовать при введении в среду нематического жидкого кристалла, для
получения контрастного изображения в электрооптических индикаторах. Можно
ожидать, что синтезированные вещества на основе производных фенотиазина,
нафтохинонов и антрахинонов будут обладать свойствами, характерными для
биологически активных соединений и
фотохромных соединений.
В молекуле фенотиазина по расчету ее
дипольного момента одна из плоскостей ароматических колец повернута по оси,
проходящей через два гетероатома, к плоскости другого арена под углом 145±5о.
В непланарной конфигурации атомы азота и серы находятся в состоянии sp3 – гибридизации. Атом
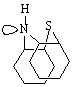
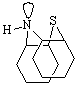
водорода, соединенный с атомом азота может занимать две позиции: Н–intra
и Н–extra
Н – intra Н – extra
В конфигурации Н–intra
неподеленная пара электронов атома азота больше связана с π – сопряженными
системами бензольных ядер, чем в конфигурации
Н–extra. Фенотиазин имеет преимущественно
конфигурацию Н–intra при отсутствии
заместителей. Но из-за стерических затруднений, она невозможна, если у атома
азота есть функциональные заместители.
Обе карбонильные группы антрахинона
снижают электронноую плотность всех положений в бензольных ядрах, и приводит в
некоторых случаях к дезактивации антрахинона в реакциях электрофильного
замещения. В то же время реакции присоединения по карбонильной группе для
антрахинона не характерны. Вследствие этого, реакция между антрахиноном и
гетероциклическим амином, протекает по механизму нуклеофильного присоединения
[3].
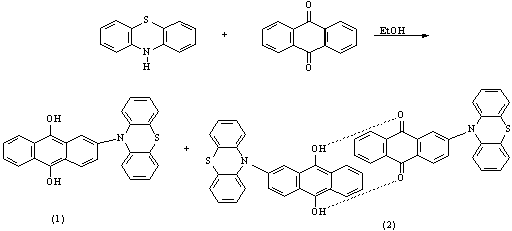
В образовавшемся
гибридном комплексе 2-N-фенотиазинилантрахинона-9,10*2-N-фенотиазинилантрагидрохинона-9,10
молекулы располагаются параллельных
плоскостях, как у семихинона [4].
Стабильность заместителя фенотиазинила обеспечивается влиянием ароматических
ядер и существенным нарушением геометрии молекул фенотиазина.
Исследования люминесценции полученных
соединений осуществляли на
спектрометрах фирмы Шимадзу модели RF-5301
PC и UV 2600.
Нами была осуществлена цепочка превращений по
известным ранее методикам:
 т.пл.=116оС, выход 80%
т.пл.=116оС, выход 80%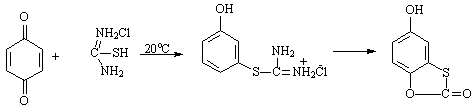
5-гидрокси-1,3-бензоксатиол-2-он,
т.пл..=154,6оС,
выход 80%
Синтез эквимольных количеств фенотиазина и
5-гидрокси-1,3-бензоксатиол-2-она осуществляли в этаноле в присутствии наночастиц Ag .
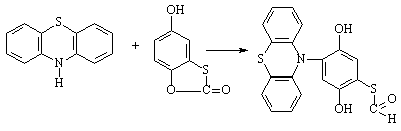
S-(2,5-дигидрокси-4-фенотиазин-10-ил-фенил)-метантиоат
Выделенные крупные светло-желтое кристаллы S-(2,5-дигидрокси-4-фенотиазин-10-ил-фенил)-метантиоата
растворяются в органических растворителях и концентрированной серной кислоте с
образованием окрашенных продуктов. (Тпл=198,8оС. Выход
77%.) Функциональный анализ подтвердил присутствие: карбонильной группы,
фенольного гидроксила, цикла фенотиазина, атома серы и атома азота (N,%=3,09±0,18).
Данные ЯМР-спектра не противоречат
предполагаемой структуре соединения S-(2,5-дигидрокси-4-фенотиазин-10-ил-фенил)-метантиоатa:
область (6,5 – 7,5 м.д.) - сложный мультиплет, образованный протонами -СН=групп бензольного кольца и
цикла фенотиазина; область (8,5 м.д.) –
синглет, образованный протонами ОН–групп; область слабого поля (9,25 м.д.)- синглет, образованный протоном
карбонильной группы.
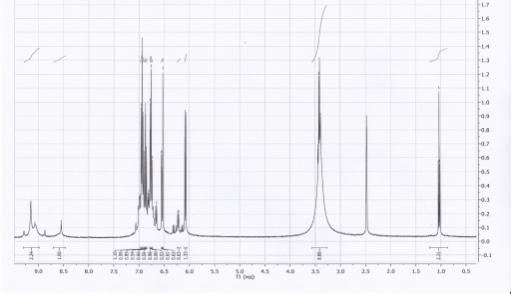
Рис.1 ЯМР-спектр S-(2,5-дигидрокси-4-фенотиазин-10-ил-фенил)-метантиоата
При
исследовании люминесцентных свойств
этого соединения при возбуждении 270 нм на спектре наблюдался максимум
при 327 нм (инт. 840).
Полученный продукт S-(2,5-дигидрокси-4-фенотиазин-10-ил-фенил)-метантиоат ацилировали эквимольным количеством хлористого ацетила:
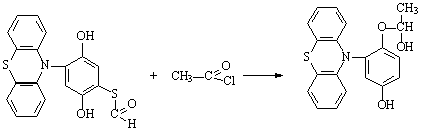
4-(1-гидроксиэтил-3-фенотиазин-10-ил)-фенол
Ацилированный
продукт - 4-(1-гидроксиэтил-3-фенотиазин-10-ил)-фенол
растворяется в щелочах, концентрированных кислотах (НС1 и Н2SO4) и спирте. (Т.пл.=237,5оС.
Выход 72%.) Функциональный анализ подтвердил наличие в молекуле фенольного
гидроксила, фенотиазинового цикла, атома азота, присутствие только одного атома
серы (S,%=2,9024±0,0005) и отсутствие карбонильной группы.
Результаты ИК-спектрометрии представлены в таблице.
Таблица. ИК-спектр
4-(1-гидроксиэтил-3-фенотиазин-10-ил)-фенола
|
Частота, см-1 |
Интенсивность |
Природа колебания |
|
3550-3200 |
интенсивная полоса со сложными контурами |
νОН, межмолекулярные водородные
связи |
|
2980-2860 |
средняя |
νСН3 при арене |
|
1600-1585 |
средняя |
ν С-Сар. |
|
1500-1400 |
средняя |
νС-Сар. |
|
1420-1330 |
средняя |
δОН |
|
1280-1230 |
слабая |
νC-N |
Данные ИК-спектра не противоречат предполагаемой структуре вещества.
При исследовании
люминесцентных свойств ацилированнного продукта при возбуждении 270 нм на спектре обнаружены максимумы при 323
нм (инт. 470) и 390 нм (инт.690).
Бром вводили в следующей цепочке
превращений:
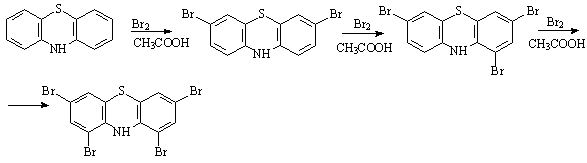
Реакцией Дильса-Альдера синтезировали
аддукт антрацена и малеинового ангидрида. Затем было получено производное на
основе дибромзамещенного фенотиазина и малеинового ангидрида.
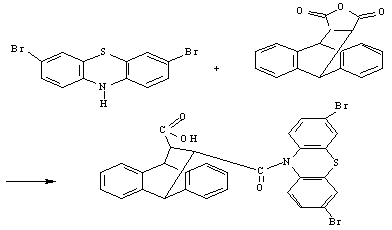
Гибридный
органолюминофор на основе дибромзамещенного фенотиазина и аддукта
2,3-(9,10-антрил)-4-он-4-(3,6-дибромфенотиазинил)-бутановая кислота обладает высокими люминесцентными
свойствами. При возбуждении 320 нм были обнаружены 4 ярких пика при 379 нм (инт.850), 401 нм (инт.940), 424 нм и 450
нм (инт.350-390)
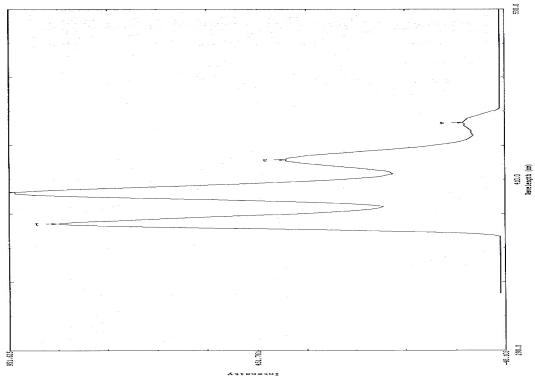
Рис.2
Спектр возбуждения
2,3-(9,10-антрил)-4-он-4-(3,6-дибромфенотиазинил)-бутановой
кислоты
Синтезированные гибридные соединения хинонофенотиазинилированной
структуры
содержат ароматические циклы и функциональные группы, способные продуцировать
свойства люминофоров. Благодаря свойствам молекул их составляющих они
могут быть рекомендованы для решения
некоторых биохимических задач.
Литература:
1.
Шагун
Л.Г., Дорофеев И.А, Токарева И.А., Смирнов В.И.,. Шагун В.А, Воронков М.Г.
Новый метод синтеза поли(3,7 - фенотиазина)// Журнал органической химии 2012,
Т.48, Вып.9, Стр. 1263-1264.
2.
Barachevsky V.A.
Photochromic quinones. Organic photochromic and termochromic compounds. Eds. J.C. Crano, Guglielmetti. N.-Y.: Plenum, 1999, I, 267.
3.
Д.Л.Емельянцев.
О.В.Мазова Синтез некоторых фенотиазинилированных
антрахинонов Materialy
miedzynarodowej konferencji«Naуeka teoria i praktika-2007», t.5,
Chemia i chemiczne technologie,
Przemysl, Р.21-25
4.
Иванский В.И. Химия гетероциклических
соединений. М.: Высшая школа, 1978, с.560