Секция №16 – Клиническая
медицина
Милованова Л.Ю., Маркина
М.М., Милованова С.Ю., Добросмыслов И.А., Лебедева М.В., Бекетов В.Д.,
Милованов Ю.С., Козловская Л.В., Мухин Н.А., Фомин В.В.
Первый Московский государственный
медицинский университет им. И.М. Сеченова, г. Москва
КАРДИОПРОТЕКТИВНАЯ РОЛЬ
ЦИРКУЛИРУЮЩЕЙ ФОРМЫ БЕЛКА KLOTHO ПРИ ХРОНИЧЕСКОЙ БОЛЕЗНИ
ПОЧЕК
В последнее время все большее
внимание в мире уделяют изучению механизмов, ингибирующих прогрессирование
сердечно-сосудистых заболеваний, в том
числе и при
хронической болезни почек, риск которых у пациентов с нарушением функции почек
возрастает в десятки раз [1, 7]. Установлено,
что одной из наиболее весомых причин
высокого риска сердечно-сосудистых осложнений (ССО) у больных ХБП является
предрасположенность к кальцификации мягких тканей, включая сердце и сосуды. Среди факторов риска кальцификации сердца и сосудов, при уремии, ведущую роль
отводят нарушению минерального обмена [5, 7, 8].
Особый интерес представляют полученные в
эксперименте и в клинике новые данные,
свидетельствующие о том, что
циркулирующая форма белка Klotho обладает способностью снижать
оксидативные процессы через активацию FoxO и увеличение экспрессии
супероксиддисмутазы, а также влиять на процессы эндотелиальной интеграции и клеточную
функцию при ХБП [2, 5 - 7].
В недавних экспериментальных
исследованиях подтверждено, что
циркулирующая форма Klotho может функционировать как
гуморальный фактор, который защищает сердечно-сосудистую систему [9 - 12].
Сверхэкспрессия Klotho обеспечивает
кардио-васкулярную протекцию [11, 13].
Целью нашего исследования было изучение взаимосвязи
сывороточного уровня белка Klotho с
кальцификацией сердца и сосудов у больных ХБП 1-5Д стадий
Материалы и методы
Исследовано 70 больных ХБП с разными стадиями ХБП (рис.
1), включающими 41 ХГН, в том числе 10 при системных заболеваниях (СКВ,
системные васкулиты), 22 при
тубулоинтерстициальном нефрите (бактериальной природы, подагрической,
лекарственный) и 7 – гипертензивном нефрослерозе, среди них 30 мужчин и 40 женщин в возрасте от 20 до 84 лет, средний
возраст на момент включения в исследование составлял 50±14,9 лет.
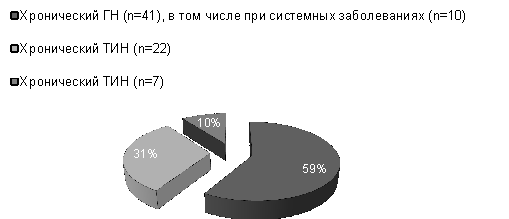
Рис. 1. Распределение
больных по этиологии ХБП
Стадии ХБП определяли
по критериям KDIGO (2009), при этом СКФ рассчитывали
по уравнению CKD-EPI (2009 г.).
Среди 49 больных с артериальной
гипертонией (АГ) у 27(55,1%) удавалось поддерживать уровень АД в пределах
целевого - 130/80-140/80 мм рт. ст с помощью ингибиторов
ангиотензинпревращающего фермента (иАПФ), блокаторов кальциевых каналов,
бета-блокаторов, диуретиков, изолированно или в сочетании в зависимости от
тяжести АГ). Остальные 22 (44,9%) антигипертензивные препараты принимали нерегулярно
и на момент начала скрининга у них сохранялась артериальная гипертензия (АД
150/90- 165/100 мм рт. ст.).
У 22 (31,4%) больных с персистирующей
гиперкальциемией и повышенным уровнем иПТГ для контроля продукции иПТГ
применяли парикальцитол.
У всех 70 больных с 1-5D стадиями ХБП изучен сывороточный уровень Klotho с использованием иммуноферментного метода ELISA с набором анти-Klotho поликлональных антител (фирма «Millipore» USA).
У больных с АГ проводили Эхокардиографическое исследование на приборе ACUSON 128 ХР10 (США) в соответствии со стандартным протоколом (Gosse et al 1990, Devereux 1990) [3 - 4].
У 57
больных на момент взятия проб крови проводили анализ ригидности сосудов с использованием прибора SphygmoCor (Австралия),
основанный на измерении пульсовых волн датчиком, установленным в области
лучевой и бедренной артерий. Для оценки степени кальцификации периферических
сосудов у этих же больных определяли
лодыжечно-плечевой индекс (англ. ABI- ankle-brachial
index). ABI = сАД
(среднее артериальное давление) на лодыжке/сАД на плече. Например, сАД мм рт. ст. на лодыжке =140, а на плече
=110, то ABI = 140/110 =1,27. Нижняя
граница нормы = 0,95-0,9; верхняя граница -
1,4-1,42.
Статистический анализ данных
проводился с помощью программ SPSS 10 for Windows, STATISTICA 10.0 и MS Excel. Для проведения корреляционного анализа
использовался коэффициент ранговой корреляции Спирмена (r).
Для признаков с нормальным
распределением результатов данные представлены в виде M±m (где M – среднее арифметическое, m – среднеквадратичное отклонение). Для
признаков с распределением, отличающемся от нормального, результаты
представлены в виде Me
[25; 75] (где Me –
медиана, 25 и 75 – 25 и 75 перцентили). Уровень значимости при сравнении групп
по признакам p<0,05.
Результаты и обсуждение
Сывороточная
концентрация Klotho различалась среди изученных больных в зависимости от стадии ХБП.
Наиболее высокий уровень отмечен у больных 1-й
стадии, уменьшаясь к 5-й стадии. Между уровнем СКФ и концентрацией белка
Klotho установлена сильная прямая корреляция [r = 0,92, p < 0,05] (рис. 2).
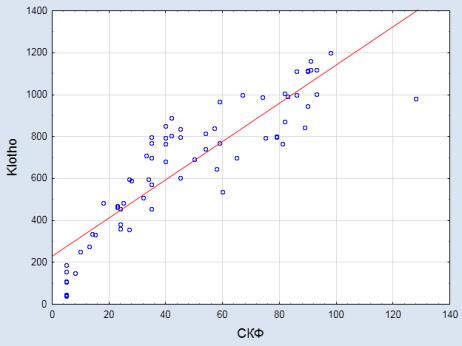
![]()
![]()
![]()
![]() Рис. 2. Зависимость сывороточной концентрации белка Klotho от СКФ
Рис. 2. Зависимость сывороточной концентрации белка Klotho от СКФ
В группе больных ХБП 5D стадии снижение
концентрации в сыворотке крови больных Klotho происходило в обратной корреляционной
зависимости от продолжительности лечения
гемодиализом [r=(-)0,760; p<0,05].
В группе больных ХБП с 3Б-4
стадиями, которым проводили лечение парикальцитолом, в отличие от группы
больных, леченных альфакальцидолом снижение Klotho в соответствии со степенью почечной
недостаточности оказалось менее значимым, при отсутствии разницы между этими группами по степени
снижения в сыворотке крови иПТГ, что можно расценивать как свидетельство
протективного, возможно стимулирующего эффекта парикальцитола на продукцию Klotho (рис. 3).

Рис. 3. Сравнительная характеристика сывороточного
уровня Klotho у пациентов ХБП с гиперпродукцией иПТГ, получавших
лечение гиперпаратиреоза парикальцитолом (n=20) и альфакальцидолом (n=22)
У больных
без АГ с нормальной ТЗСЛЖ (до 0,9 см, n = 14)
концентрация Klotho оказалась больше, чем у
больных с начальной гипертрофией ЛЖ (ТЗСЛЖ ≥ 1,0 см, n = 5), p < 0,05
(рис. 4).
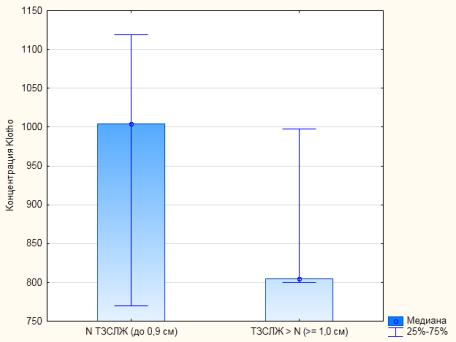
Рис. 4. Медиана значений сывороточной концентрации
белка Klotho у больных с нормальной ТЗСЛЖ и больных
с начальной гипертрофией ЛЖ
Между уровнем белка Klotho и ТЗСЛЖ у больной с
артериальной гипертензией выявлена обратная корреляционная зависимость [r =
(-)0,594, p < 0,05]. У
этих больных также обнаружена обратная корреляционная зависимость между сывороточной концентрацией Klotho [r=(-)0,537; p<0,05] и
скоростью распространения пульсовой волны. Среди больных с АГ выявлена
обратная корреляция между максимальным
уровнем систолического АД (мм.рт.ст.) и
концентрацией Klotho [r = -6,03, p < 0,
05], а также положительная корреляция между фракцией выброса в % и содержанием Klotho (r = 0,68, р <
0,05).
У этих же больных сниженная концентрация Klotho в сыворотке крови
были ассоциирована с большей
частотой выявления кальцификатов в сердце и магистральных артериях [r= (-) 0,584; p<0,01],
увеличение жесткости артерий [r= (-) 0,454; p<0,05]
и снижением кровотока в артериях голени (лодыжечно-плечевой индекс) [r= (-) 0,380; p<0,05].
При этом среди больных 3Б-4 стадиями ХБП c достигнутым целевым уровнем АД более высокие
показатели Klotho [r = (+) 0,509; p< 0,01] и менее выраженное ремоделирование миокарда
отмечены у тех из них, у кого для коррекции гипертонии использовались иАПФ, а
не другие антигипертензивные препараты.
Заключение
Полученные нами данные свидетельствуют о связи
циркулирующей формы белка Klotho с развитием сердечно-сосудистых
осложнений через участие в процессах кальцификации сосудов и ремоделирование
сердца. На их основании правомочен вывод о том, что циркулирующая форма белка Klotho может служить ингибитором ремоделирования
сердца и сосудов при ХБП,
При этом, по результатам проведенного нами
исследования можно допустить возможность практического использования
определения сывороточной концентрации Klotho в
качестве раннего диагностического маркера повышенного
риска развития почечно-кардиального повреждения.
Необходимы дальнейшие
исследования изменений метаболизма Klotho в условиях применения ингибиторов АПФ,
парикальцитола и ряда других препаратов традиционной нефропротекции у больных
ХБП для уточнения возможности медикаментозной стимуляции продукции Klotho.
Можно предполагать, что возмещение
дефицита Klotho у пациентов с ХБП
является перспективным направлением в оптимизации кардиопротективной стратегии.
Литература
1. Borst M. H., Vervloet M. G.
Cross Talk Between the Renin-Angiotensin-Aldosterone System and Vitamin
D-FGF-23-klotho in Chronic Kidney Disease // Am.
J. Soc. Nephrol. – 2011. –
Vol. 22, № 9. – P. 1603–1609.
2. Chung-Yi C., Makoto K., Mohammed S. Razzaque Molecular Regulation of Phosphate Metabolism by Fibroblast
Growth Factor-23–Klotho System: // Adv Chronic Kidney Dis. – 2011. – Vol. 18, № 2. – P. 91–97.
3. Devereux RB. The value of
noninvasive measurements in hypertension. // J. Am. Med. Assoc. – 1990.
– Vol. 264, № 21. – P. 2798-9
4. Gosse P, Roudaut R, Dallocchio M. Is
echocardiography an adequate method to evaluate left ventricular hypertrophy
regression? // Eur Heart J. – 1990.
– Vol 11 (Suppl G). P 107-12
5. Haruna Y., Kashihara N., Satoh M. et al. Amelioration
of progressive renal injury by genetic manipulation of Klotho gene // Proc. Natl .Acad. Sci. U S A. – 2007. – Vol. 104. – P. 2331–2336
6. Hu M.C.,
Shi M., Zhang J. et al. Klotho deficiency causes vascular calcification in
chronic kidney disease // Am. J. Soc.
Nephrol. – 2011. – Vol. 22, № 1.
– P. 124-136
7. Kuro-o M. Klotho in chronic kidney disease—What's new? // Nephrology
Dialysis Transplant. – 2009. – Vol. 24,
№ 6. – P. 1705-1708
8. Maltese G., Karalliedde J. The Putative Role of the Antiageing Protein Klotho in Cardiovascular and Renal
Disease // Int. J. Hypertens. – 2012. – Vol. 2012. – P. 757469.
9. Milovanova L.Yu., Milovanov Yu.S., Kozlovskaya L.V. The
place of paricalcitol in nephroprotrctive strategy of predialysis chronic
kidney disease due to systemic diseases // Arh. Evromed. – 2011. – Vol. 3. – P.
69-78
10. Milovanova
L., Milovanov Y., Plotnikova A. Phosphorus and Calcium Metabolism Disorders
Assosiated with Chronic Kidney Disease Stage III-IV (Systematic Rewiew and
Meta-Analysis) // Chronic Kidney Disease and renal Transplantation. Ed. by
Manisha Sahay. INTECH. – 2012. – P. 95-118
11. Semba R.
D., Cappola A.
R., Sun K. et al. Plasma klotho and cardiovascular disease in adults //
Am. J. Geriatr. Soc. – 2011. – Vol. 59, № 9. – P. 1596–1601
12. Mitani H., Ishizaka N., Aizawa T. et al. In
vivo Klotho gene transfer ameliorates angiotensin II-induced renal damage //
Hypertension . – 2002. – Vol. 39. – P. 838–843
13.
Wang Y., Sun Z. Klotho Gene Delivery Prevents the
Progression of Spontaneous Hypertension and Renal Damage // Hypertension . – 2009. – Vol. 54.
– P. 810–817