Морфологические исследования при остеопорозе костей
в экспериментальных условиях
С.У.Асилова, С.Ш.Рашидова, Б.Ш.Убайдуллаев, К.А.Юсупова, Г.Ш Умарова,
Г.К. Нуримов, Н. Р.Вахидова
В настоящее время проблема иммобилизационого остеопороза приобретает все большее значение, как с теоретической, так и с практической точки зрения. Между тем процессы перестройки костной ткани под влиянием ограничения двигательной активности изучены недостаточно, а имеющаяся литература по этому вопросу немногочисленна.
Исходя из динамики развития костной ткани после щадящих способов нарушений костной пластинки можно полагать, что способ создания трещин в кости можно использовать как стандартную модель для проведения экспериментальных исследований. Это основано на том, что репаративные процессы, возникающие после указанного способа кортикотомии приближены по срокам к репаративному процессу после самого щадящего способа нарушения тканей, т.е. отделения надкостницы от кортикальной пластинки. Известно, что переломы костей вызывают глубокие и многообразные изменения в организме как общего, так и местного характера. В дальнейшем включение компенсаторных механизмов приводит к усилению анаболических процессов, что объясняет репаративную регенерацию костной и мягких тканей, поврежденных при переломе.
К числу актуальных проблем на современном этапе является развитие учения о регенерации в процессе репаративного остегенеза. Разрешение этой проблемы имеет не только теоретические знания, но и может создать предпосылки для практического использования достижения для своевременной диагностики с целенаправленным лечением и прогноза возможных осложнений в виде извращенного или замедленного течения процессов мозолеобразования при заживлении переломов. По мнению некоторых авторов репаративная реакция возникает в зоне повреждения в результате острых местных нарушений кровообращения, а процесс перестройки вызывается в кости перераспределительными нарушениями микроциркуляции, которые возникают в результате изменения гидродинамических соотношений между смежными сосудистыми бассейнами. Репаративная восстановительная регенерация, в отличие от физиологической, выражается в перестройке костной ткани в нормальных условиях жизнедеятельности организма и наблюдается при повреждении костной ткани и направлена на восстановление анатомии и функции кости. Вышеизложенное заставляет искать более эффективные методы лечения, во избежание побочных явлений.
Несмотря на значительные успехи в лечении переломов костей и их осложнений, существующие методы лечения еще не полностью удовлетворяют врачей и побуждают их вести активные поиски дополнительных средств, которые могли бы сократить сроки пребывания больных в стационаре и сроки их нетрудоспособности. Одним из таких средств является хитозан и модифицированный хитозан.
Уплотнение костной ткани при применении хитозана и модифицированного
хитозана объясняется стимулирующим действием на ферментную систему
остеобластов, что по мнению многих авторов ведет к ускорению образования
органической матрицы кости. Имеются так же данные об ускорении образования
костной мозоли при лечении переломов препаратами хитозана. Механизмы действия
хитозана и модифицированного хитозана до конца не изучены. Установлена
избирательная активация остеобластов, а также повышение устойчивости
минерального вещества кости к резорбции в результате связывания препарата
гидроксиаппатитом.
Данные литературы, лабораторных и экспериментальных
исследований позволяют выделить возможные механизмы действия стимуляции
остеорепарации. Результаты морфологического исследования дают основание
считать, что смысл стимулирующего действия хитозана и модифицированного
хитозана заключается в усилении клеточной пролиферации и дифференцировании
малодифференцированных клеток, в назревании образования остеобластов и
активизации их функции.
МАТЕРИАЛЫ И МЕТОДЫ
ИССЛЕДОВАНИЯ
Эксперимент был проведен в ЦНИЛ на базе ТМА. Для исследования были взяты 25 половозрелых кроликов породы «Шиншилла», весом 2500-3000 г. У кроликов операционным путем, под внутривенным барбитуратным наркозом производилась остеотомия правой бедренной кости и с целью развития остеопороза оперированная конечность иммобилизировалась. У экспериментальных животных через 50-55 дней выявлен остеопороз. На основании данных ангиорентгенографии и после подтверждения остеопороза животные были распределены на 3 группы: первая группа - 10 кроликов служили контролем и, после снятия иммобилизационной повязки, животные свободно находились в клетках без каких-либо воздействий, во второй группе - 15 кроликам введен per os хитозан утром в суспензии дистиллированной воды 1,8 г на кг веса 1 раз в день в течение двух месяцев, в третьей группе - 15 кроликам введен per os хитозан 1,8 г на кг веса 1 раз в день + активный кальций из расчета в соотношении к хитозану 1:1 в течение двух месяцев.
Хитозан имеет собственную биологическую активность, получается из переработки отходов хлопка и кокона шелкопряда. Хитозан природный полимер, относится к группе парафармацевтиков, обладая лечебной фармацевтической активностью, биоразлагаемый на гликозамины и аминогликаны, выводится из организма свободно, на уровне поваренной соли, не токсичный.
Для морфологического исследования взят материал (с обеих конечностей, как с остеопорозной, так и здоровой) из бедренной кости, как с метафиза, так и диафиза. Взятый материал фиксирован в 10% нейтральном формалине и декальцинирован в 5% азотной кислоте,полученные препараты окрашены гематоксилином и эозином по методу Ван-Гизона.
Результаты и обсуждение.
Результаты микроскопического исследования костной ткани на 15 день
после начала моделирования остеопороза показали, что отмечалось бурное
рассасывание костной пластинки, которое проявилось истончением костных
балок, неравномерным рассасыванием как со стороны периоста, так и со
стороны эндооста. Костные балки становились неравномерными по толщине,
базофильными по окрашиванию. Со стороны периоста отмечалось
хондроматозное перерождение костных балок (рис.1), а со стороны эндооста
появилась просветленная бесклеточная полоса. Костный мозг стал
рыхлым, отечным, малоклеточным, гаверсовы каналы
стали неравномерно расширенными и заполнились в одних местах липонитами,
в других участках грануляционной тканью, богатой воспалительными клетками как
полинуклеарного, так и мононуклеарного происхождения.
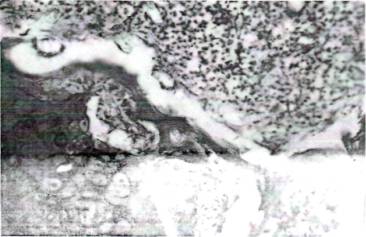
Рис. 1. На 15 день остеопороза. Хондраматозное перерождение и истончение костных балок, разрыхление костного мозга. Окраска: гематоксилином и эозином. УВ: 10. об.40.
На 22 день эксперимента костные балки становились еще больше деформированными и неровными. Местами отмечалось появление внутренних костных переломов за счет истончения и замещения мягкоткаными прослойками костных балок. В толще костных балок появились очаги базофильного окрашивания за счет неравномерного распределения кальция, а также хондроматозного перерождения. По периферии костных балок из клеточного состава преобладали остеокласты над остеобластами. Они становились более крупными за счет активации, как цитоплазмы, так и ядерных структур. Гаверсовы каналы стали значительно расширенными, в просвете появились жировые клетки, грануляционная ткань и воспалительный инфильтрат (рис.2). Среди воспалительного инфильтрата преобладали лимфоидные клетки и макрофаги ' как моноцитарного, так и остеокластического происхождения.
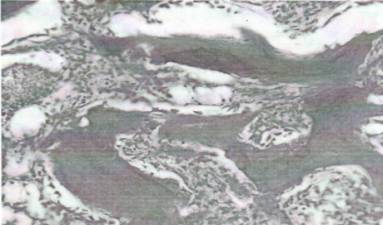
Рис. 2. 22 день эксперимента. Деформация костных балок за счет остеопороза, расширение гаверсовых каналов за счет липоматоза, разрастания грануляционной ткани и воспалительной инфильтрации. Окраска: гематоксилином и эозином. УВ: ок.10, об.40.
На 29 день эксперимента костные балки в одних местах становились деформированными и неровными, в других местах истонченными. Местами отмечалось появление разрушения и лизиса твердой костной ткани в виде дефекта и просветления костных балок. В толще костных балок увеличились очаги базофильного окрашивания за счет неравномерного распределения кальция, а также хондроматозного перерождения. На границе костных балок и мягкотканых прослоек появились осадки извести кальция и фрагменты разрушения твердых костных отломков. Остеокласты располагались вдоль костных балок с признаками рассасывания костной ткани. В просвете гаверсовых каналов увеличились воспалительные клеточные элементы, как лимфоидного, так и гистиоцитарного происхождения (рис.2). Среди воспалительного инфильтрата стали преобладать макрофаги как моноцитарного, так и остеокластического происхождения.
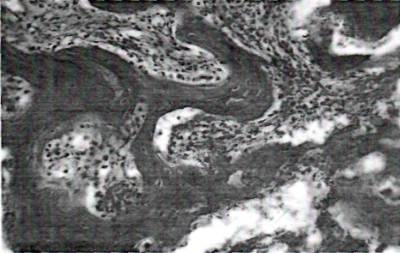
Рис.3. 29 день эксперимента. Сохранение деформации костных балок, преобладание в гаверсовых каналах воспалительных клеток. Окраска: гематоксилином и эозином. УВ: ок.10, об.40.
На 36 день эксперимента отмечалось развитие в костной ткани атрофических и деструктивных изменений. При этом дистрофические и атрофические изменения распространялись со стороны проксимального отдела в сторону дистального отдела. Компактные костные пластинки неравномерно обызвествленные, особенно в краевых зонах более слабые, иногда с остеокластами на поверхности. Встречались балычки с наслоениями остеоида. Встречались также участки, заполненные рыхловолокнистой тканью, иногда очаги миксаматозного характера. По ходу всех костных пластинок появились очаги бесклеточного просветления (рис.4), где с наличием отрывков костной ткани и кальцинатов. Между компактными костными пластинками большая площадь захвачена рыхлой волокнистой соединительной тканью. В отличие от предыдущих сроков эксперимента отмечалось значительное уменьшение в составе мягкой ткани клеточных элементов. Единичные клетки, находящие в толще соединительной ткани, были хондробластического или макрофагального вида, волокнистые структуры расположены хаотично и между собой переплетены, формируя относительно толстые волокнистые пучки.
Таким образом, результаты морфологического исследования костной ткани, в различные сроки после моделирования остеопороза, показали развитие последовательных дистрофических, деструктивных и атрофических изменений. Причем они начались с проксимального отдела костей и распространялись в сторону дистального отдела, в основном поражалась диафизарная часть костей. С начальных сроков эксперимента отмечалось бурное рассасывание костной пластинки, расширением гаверсовых каналов с развитием в них грануляционной ткани и появлением воспалительной инфильтрации. В последующие сроки эксперимента со стороны костных пластинок отмечались еще более атрофические и деструктивные изменения в виде хондроматозного перерождения и неравномерного кальциноза. Со стороны гаверсовых каналов нарастало разрастание волокнистой соединительной ткани в виде фиброзной дисплазии кости.

Рис.4. 36 день эксперимента. Значительная атрофия компактных костных пластинок, замещение волокнистой соединительной тканью. Окраска: гематоксилином и эозином. У в: ок. 10. Об.40.
Морфологическое
исследование костной ткани после лечения хитозаном.
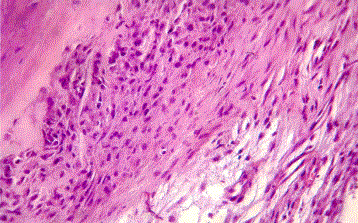
Рис. 5. Микроскопический фрагмент костной ткани на 7 день после лечения остеопороза хитозаном.
Как видно из рисунка, компактная костная ткань уплотнена и гиперхромна, окрашена эозином более интенсивно. В окружающей зоне компактной кости надкостница значительно утолщена за счет пролиферации фибробластов и фиброцитов. Эти соединительно-тканные клеточные элементы по окрашиваемости и размеру более активные и формируют плотный клеточный инфильтрат вокруг компактной костной ткани. С наружной стороны этот инфильтрат также плотно контактируется прослойками надкостницы. Последняя более рыхлая и отечная, местами с очагами лимфогистиоцитарной инфильтрации.
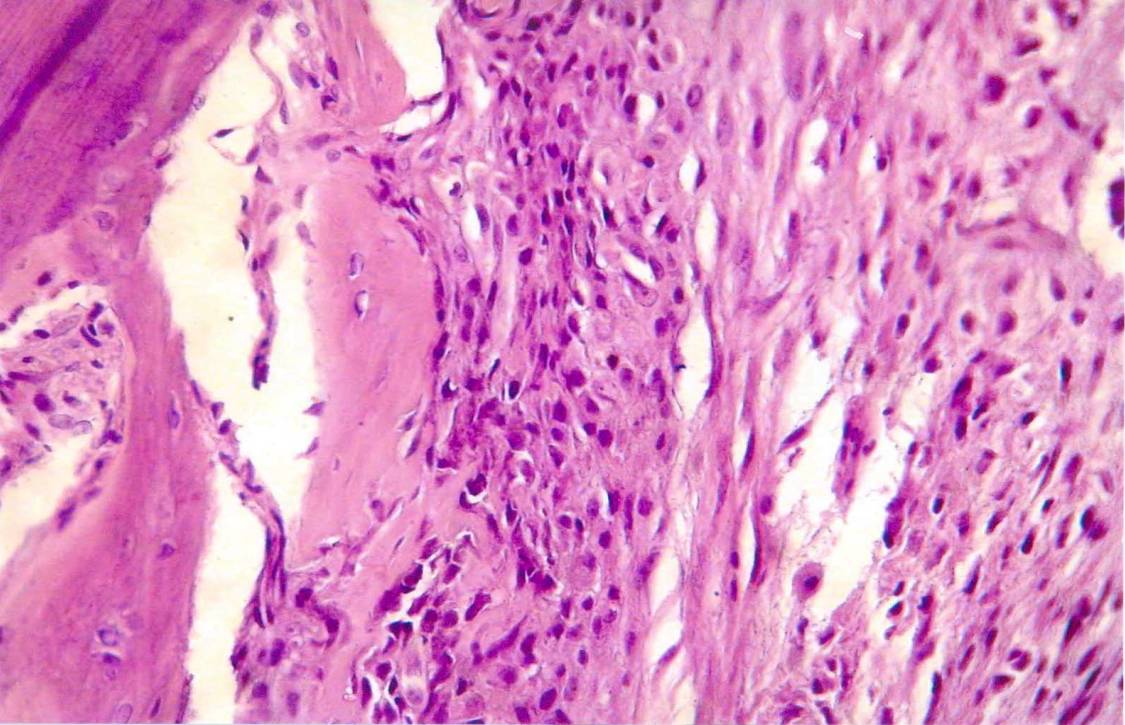
Рис. 6. На 14 день после лечения остеопороза хитозаном отмечалось еще большее уплотнение и утолщение компактной костной ткани за счет новообразование компактной костной массы со стороны окружающей фиброцитарной клеточной инфильтрации. При этом отмечалась метапластическая трансформация фибробластов и фиброцитов в остеобласты, которые в отличие от фиброцитарных клеток более интенсивно окрашены эозином более интенсивно, также ядерные структуры более крупные и гиперхромные. Вокруг остеобластов отмечается новообразование гомогенной костной массы, которые сливаются с основной компактной костной тканью. С наружной стороны клеточного инфильтрата ткань надкостницы остается утолщенной и разрыхленной.
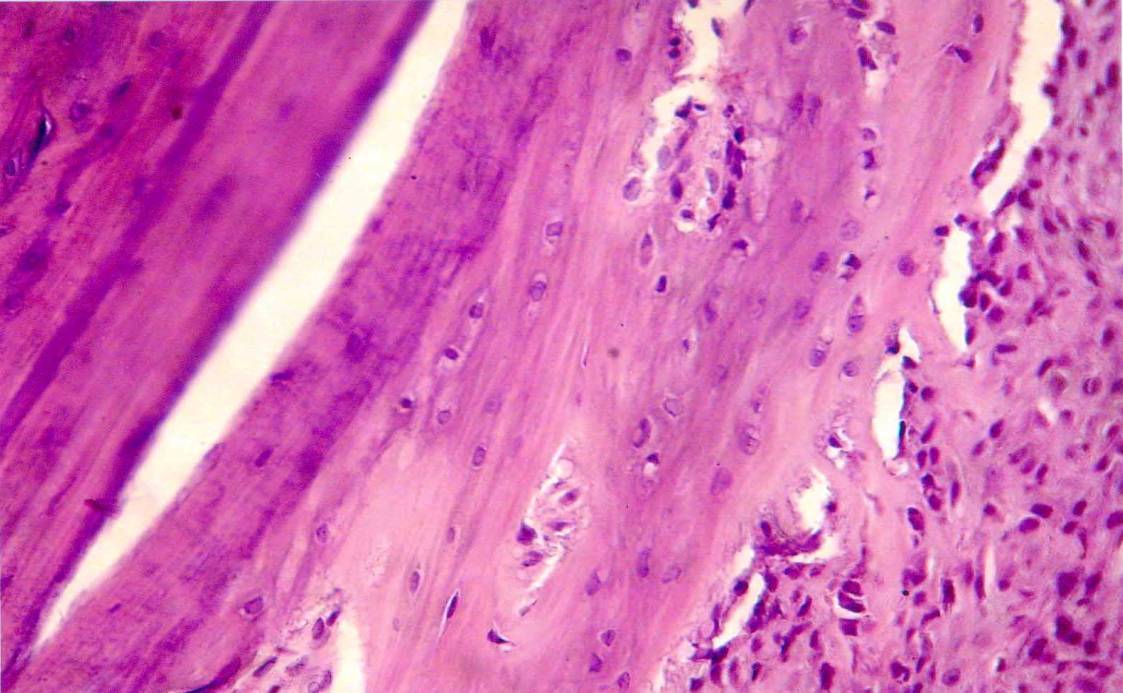
Рис.7. В более поздние сроки эксперимента со стороны компактной костной ткани отмечалось значительное уплотнение и гиперхромазия как со стороны остеоидных клеточных элементов, так и со стороны остеоидной массы. При этом старая костная ткань по своей окрашиваемости и плотности отличается от новообразованной костной ткани. Если в составе старой костной ткани преобладает наличие очагов окостенения и петрификации, то в составе новообразованной костной ткани много волокнистой остеоидной массы, также клеточные элементы более крупные и активные. Гаверсовые каналы также более расширенные, сохраняются гиперхромные остеобласты и сотеокласты.
Морфологическое исследование костной ткани после лечения хитозаном и активным кальцием
Приведем результаты морфологического исследования влияния модифицированного хитозана на процессы репаративной регенерации костной ткани при экспериментальном остеопорозе. На 7 день введения препарата первоначальные изменения, характеризующие активации репаративной регенерации были обнаружены со стороны сосудисто-стромальных элементов эндооста костной ткани. Сосуды гаверсовых каналов были расширенными, полнокровными с активацией клеточных элементов в виде гипертрофии как эндотелиальных, так и перицитарных клеток. Клеточные элементы соединительной ткани гаверсовых каналов становились активными в виде гиперхромазии и гипертрофии ядерных структур (рис.5). Большинство фибробластов дифференцировалось в остеобласты и они перемещались в сторону компактной костной пластинки. Остеобласты со своей эозинофильной цитоплазмой приближались к внутренней поверхности костной пластинки, формируя новообразованные остеоидные мозоли. При этом, со стороны компактной кости также отмечалась активация в виде гиперхромазии остеоида, гипертрофии остеоцитов.

Рис. 5. На 7 день после введения модифицированного хитозана. Расширение
сосудов, гиперхромазия и гипертрофия клеточных элементов соединительной ткани, появление первичного остеоида. Окраска:
гематоксилином и эозином. Ув: ок. 10,об.90.
Необходимо отметить тот факт, что в начальных сроках после введения модифицированного хитозана в костях, подвергнутых остеопорозу, происходило увеличение количества крупных гиперхромных клеток остеобластов и остеокластов (рис.6), которые располагались в составе соединительной ткани гаверсовых каналов. Цитоплазма их была обогащена гематоксилиновыми включениями кальциноза. Остеобласты присоединились с компактной костной пластинкой, формируя новообразованные остеоидные прослойки.
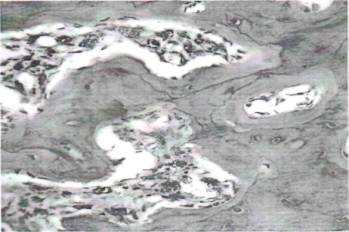
Рис.6. На 7 день после введения модифицированного хитозана. Появление в составе соединительной ткани гаверсовых каналов крупных остеобластов и остеокластов. Окраска: гематоксилином и эозином. Ув: ок. 10, об. 90.
На 14 день введения модифицированного хитозана отмечалось развитие более выраженных признаков репаративной регенерации костной ткани в виде выраженной пролиферации фибробластов как со стороны периоста, так и со стороны гаверсовых каналов. Они были крупными, активными, гиперхромными, большинство из них находились в состоянии дифференцировки в остеобласты и остеоциты (рис.7). Цитоплазма их была обогащена как эозинофильной белковой массой, так и гематоксилиновыми включениями кальциноза. Пролиферативные очаги этих клеток, как со стороны периоста, так и со стороны гаверсовых каналов формировали новообразованные остеоидные тканевые элементы, которые являются доказательством усиленной репаративнои регенерации костной ткани под действием модифицированного хитозана.
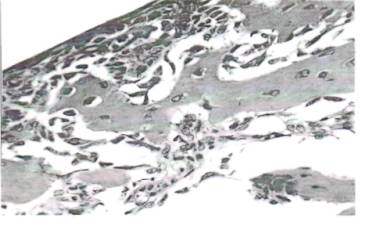
Рис. 7. 14 день введения модифицированного хитозана. Усиленная пролиферация фибробластов, остеобластов, как со стороны периоста, так и гаверсовых каналов. Окраска: гематоксилином и эозином. Ув: ок. 10, об.90.
На 21 день введения модифицированного хитозана в исследуемой костной ткани признаков остеодистрофии и остеопороза не осталось. Вместо них отмечалось развитие пролиферативных процессов, характерных для усиленной репаративной регенерации костной ткани. При этом, со стороны гаверсовых каналов отмечалась выраженная фибробластическая и остеобластическая реакция с формированием прослоек новообразованной остеоидной ткани как на поверхности компактной кости, так и в просвете гаверсовых каналов (рис.8). На поверхности компактной костной пластинки остеобласты располагались в виде частокола в один ряд с признаками остеосинтеза. В просвете гаверсовых каналов остеобласты формировали параллельно идущие прослойки остеоидной костной мозоли, которые местами соединяются с компактной костной пластинки и утолщают их.
Аналогичные морфологические изменения отмечались со стороны периостальной поверхности кости в виде формирования новообразованных остеоидных костных прослоек (рис.9).
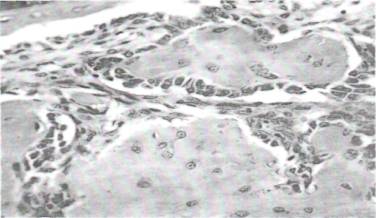
Рис. 8. На 21 день введения модифицированного хитозана. Репаративная регенерация фибробластов и остеобластов на поверхности костной пластинки и в просвете гаверсовых каналов.
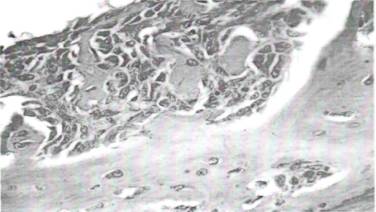
Рис. 9. На 21 день введения модифицированного хитозана. Пролифераты фибробластов и остеобластов со стороны периоста. Окраска: гематоксилином и эозином. Ув: ок. 10, об. 90.
Таким
образом, результаты морфологического исследования влияния
модифицированного хитозана и модифицированного хитозана доказывают о
развити усиленной репаративной регенерации на фоне остеопороза в виде
пролиферации фибропластической и остеобластической первичной костной
мозоли. Причем такая восстановительная клеточная реакция одновременно развивается
как со стороны периостальной поверхности, так и со стороны гаверсовых каналов.
В динамике после введения хитозана в пораженной костной ткани морфологические
признаки остеопороза быстро заменяется остеорегенеративным процессом и к 21-ому
дню эксперимента как костные пластинки, так и гаверсовые каналы полностью
восстанавливаются.
Выводы:
1. Использование хитозана и модифицированного хитозана на экспериментальных животных при моделированном остеопорозе, вызвало усиление процессов остеорегенерации и оссификации, сопровождаясь видимым уменьшением признаков остеопороза.
2.
Морфологическое
исследования влияния хитозана и
модифицированного хитозана показывают усиление остеогенеза и
остеорегенерации в виде роста клеток фибробластической и остеобластической ветки, которая формирует
первичную костную мозоль.
3. Наилучшие показатели остеорегенерации кости отмечаются с 21 дня эксперимента и далее после введения хитозана и модифицированного хитозана в пораженную костную ткань, выражаясь в полном восстановлении гаверсовых каналов и костной пластинки.
Литература:
1. Шевцов
В.И,, Свешников А. А., Овчинников Е. Н.,
Бегимбетова Н. Б., Репина И. В., Буровцева А. И. Возрастные изменения минеральной плотности
костей скелета/Гений ортопедии.-2004.- №1. С.129-137
2.
Родионова С.С., Балберкин
A.B., Колондаев А.Ф., Швец В.Н., Ильина В. К. Принципы патогенетически
обоснованного лечения первичного остеопороза. Пособие для врачей. Москва, 2003.
- 25 С.
3.
Родионова С.С., Макаров М.А.,
Колондаев А.Ф., Гаврюшенко.Н.С. Значение минеральной плотности и показателей
качества костной ткани в обеспечении ее прочности при остеопорозе // Вестник
травматологии и ортопедии. 2001. - № 2. - С. 76-80.
4. Binkley N., Krueger D., Vallarta-Ast N. An
overlying fat panniculus affects femur bone mass measurement // J. Clin.
Densitom. 2003. - Vol. 6. - No. 3.-P. 199-204.
5. Bouillon R.A., Auwerx J.H., Lissens W.D.,
Pelemans W.K. Vitamin D status in the elderly: seasonal substrate deficiency
causes 1,25-dihydroxycholecalciferol deficiency // Am. J. Clin. Nutr. 1987. -
Vol. 45. -No. 4.-P. 755-763.
6. Boyanov M.A. Prevalence of low central bone
mineral density in a bulgarian female referral population: a pilot study //
Rheumatology Int. Accepted 22 May 2005.
7. Casado E., Larrosa M., Gómez A.,
Gratacos J., Fernández E., Berlanga E. Sunlight irradiation, 25-OH-D3
serum levels and osteoporotic hip fracture // J. Bone Miner. Res. 2004. - Vol.
19 (Suppl. 1). - P. S162.
8. Cheung A.M., FeigD.S., KapralM.,
Diaz-Granados N. Dodin S. Prevention of osteoporosis and osteoporotic fractures
in postmenopausal women: recommendation statement from the Canadian Task Force
on Preventive
9. Cook R.B., Collins D.,
Tucker J., Zioupos P. Comparison of questionnaire and quantitative ultrasound
techniques as screening tools for DXA // Osteoporosis Int. Accepted: 31 January
2005.
10. Cortet B., Dubois P., Boutry N., Palos G.,
Cotten A., Marchandise X. Computed tomography image analysis of the calcaneus
in male osteoporosis // Osteoporosis Int. 2002. - Vol. 13. - No. 1. - P. 33-41.
11. Dawson-Hughes B. Estimates of optimal vitamin
D status // Osteoporosis Int. 2005. - Vol. 16. - No. 7. - P. 713 - 716.
12. Delmas P.D., van de Langerijt L., Watts N.B.,
Eastell R., Genant H., Grauer A., Cahall D.L. Underdiagnosis of vertebral
fractures is a worldwide problem: the IMPACT study // J. Bone Miner. Res. 2005.
- Vol. 20. - No. 4.-P. 557-563.
13. AS.Deplas A., Debiais F., Alcalay M., Bontoux
D., Thomas P. Bone density, parathyroid hormone, calcium and vitamin D
nutritional status of institutionalized elderly subjects // J. Nutr. Health
Aging. 2004. - Vol. 8. -No. 5.-P. 400-404.
14. Edwards B.J., Iris M., Ferkel E., Feinglass
J. Postmenopausal women with minimal trauma fractures are unapprised of the
existence of low bone mass or osteoporosis // Maturitas. Accepted 19 May 2005.
15. Ekman A. Hips at risk osteoporosis and
prevention of hip fractures // Dissertation for the degree of Doctor of
Philosophy in orthopaedics. Eklundshofs Grafiska, Uppsala. 2001. - 72 p.
16. El-Desouki M.I., Sherafzal M.S., Othman S.A.
Comparison of bone mineral density with dual energy x-ray absorptiometry,
quantitative ultrasound and single energy x-ray absorptiometry // Saudi Med. J.
2005. - Vol. 26. - No. 9.-P. 1346-1350.
17. . Faulkner K.G., Weynand
L.S., Barden H.S., Wacker W.K. Effects of technology and operator experience on
bone densitometry precision error // Bone. 2005. - Vol. 36 (Suppl. 2). - P.
s317.
18. Flicker L., Maclnnis R.J., Stein M.S.,
Scherer S.C., Mead K.E., Nowsoni
19. C.A., Thomas J., Lowndes C., Hopper J.L.,
Wark J.D. Should all older people in residential care receive vitamin D to
prevent falls? Results of a randomised trial // J. Bone Miner. Res. 2004. -
Vol. 19 (Suppl. 1). - P. s99.
20. Ganesan K., Teklehaimanot S., Tran T.H.,
Asuncion M., Norris K.• Relationship of C-reactive protein and bone mineral
density in communitydwelling elderly females // J. Natl. Med. Assoc. 2005. -
Vol. 97. - No. 3. -P. 329-333.
21.
Gillespie W.J., Avenell A.,
Henry D.A., O'Connell D.L., Robertson J. Vitamin D and'vitamin D analogues for
preventing fractures associated5 with involutional and post-menopausal
osteoporosis // Cochrane Database Syst. Rev.-2001.-No. 1 : CD000227.